Общие характеристики
Оба кроссовера класса «К2». Hyundai Santa Fe и Skoda Kodiaq могут предложить покупателям на выбор передний привод, а также полный. Наиболее привлекательным остается полный привод. Учитывая особенности наших дорог, переплата за такую опцию себя оправдывает.
| Автомобиль | Шкода Кодиак | Хендай Санта фе |
| Средняя цена новой машины | ~ 1 688 000 | — |
| Тип топлива | Бензин АИ-95 | Бензин |
| Тип кузова | SUV | SUV |
| Тип трансмиссии | РКПП 6 | АКПП 8 |
| Тип привода | Полный (4WD) | Передний (FF) |
| — | — | |
| Объем двигателя, куб.см | 1395 | 1998 |
| Мощность | 150 л.с. | 240 л.с. |
| Максимальный крутящий момент, Н*м (кг*м) при об./мин. | 250 (26) / 3500 | 353 (36) / 3500 |
| Объем топливного бака, л | 60 | 71 |
| Число дверей | 5 | 5 |
| Объем багажника, л | 635 | 130 |
| Время разгона 0-100 км/ч, с | 9.9 | — |
| Масса, кг | 1625 | 1680 |
| Длина кузова | 4697 | 4770 |
| Высота кузова | 1676 | 1680 |
| Колесная база, мм | 2791 | 2765 |
| Клиренс (высота дорожного просвета), мм | дорожного просвета), мм”>187 | 195 |
| Расход топлива, л/100 км | 7.5 | 10.5 |
| Задние колеса | 215/65 R17 | 235/60 R18 |
| Число мест | 5 мест | 7 мест |
Последнее поколение Санта Фе появилось в 2021 году. Учитывая разницу в два года с Шкода Кодиак у инженеров «Hyundai» было больше времени подготовить свой автомобиль к современным стандартам автомобилестроения.
Хотя по экстерьеру нельзя сказать, что есть преимущества. Та же решетка радиатора с объединенной оптикой, большое количество острых линий, широкие арки колес.
Петритест — микробиологические экспресс-тесты — санитарная микробиология. текст лекций. кондакова г.в.
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Ярославский государственный университет им. П.Г. Демидова
Г.В. Кондакова
Санитарная микробиология
Текст лекций
Рекомендовано Научно-методическим советом университета
для студентов специальности Биология
Ярославль 2005
УДК 579.63 ББК Е4я73
К 64
Рекомендовано
Редакционно-издателъским советом университета в качестве учебного издания.
План 2005 года
Рецензенты:
Доктор биологических наук, профессор кафедры биологии почв МГУ им. М.В. Ломоносова А.Л. Степанов;
кафедра микробиологии с иммунологией и вирусологией Ярославской государственной медицинской академии
Кондакова, Г.В. Санитарная микробиология: Текст лекций К 64 / Г.В. Кондакова; Яросл. гос. ун-т. — Ярославль: ЯрГУ, 2005. — 84 с. ISBN 5-8397-0363-Х
В лекциях изложены общие вопросы санитарной микробиологии (принципы и методы, учение о санитарно-показательных микроорганизмах, патогенные микроорганизмы в окружающей среде), а также специальные, касающиеся санитарно-микробиологической оценки качества объектов окружающей среды (воды, почвы, воздуха, предметов обихода и оборудования). Материал изложен с учетом последних изменений ныне действующих и вновь принятых нормативных документов в области санитарно-гигиенического законодательства (ГОСТов, СанПинов, приказов Министерства здравоохранения РФ и Главного санитарного врача РФ, и др.).
Предназначено для студентов, обучающихся по специальности 011600 Биология (дисциплина «Санитарная микробиология», блок СД), очной формы обучения. Может быть использовано не только студентами, но и аспирантами и научными сотрудниками, специализирующимися в области микробиологии и охраны окружающей среды.
Рис. 3. Табл. 13. Библиогр.: 19 назв.
УДК 579.63
ББК Е4я73
© Ярославский государственный
университет, 2005
© Г.В.Кондакова, 2005
ISBN 5-8397-0363-Х
Введение
Произошедшие в последние годы в стране радикальные социально-экономические и политические перемены требуют принципиально новых подходов в решении вопросов охраны окружающей среды и обеспечения санитарно-эпидемиологического благополучия населения. Одним из таких подходов является совершенствование системы подготовки специалистов, профессиональная деятельность которых будет связана с природоохранной сферой. Разработка природоохранных мероприятий по предотвращению и устранению биологического загрязнения окружающей среды, оказывающего непосредственное влияние на здоровье человека, является предметом внимания именно специалистов-экологов. В связи с этим преподавание в вузах общей микробиологии невозможно без акцентирования внимания студентов на различных аспектах санитарной микробиологии.
Дисциплина «Санитарная микробиология» входит в блок общепрофессиональных дисциплин и является курсом по выбору. Она обеспечивает приобретение знаний в соответствии с государственным стандартом, содействует углублению и расширению представлений студентов о роли микроорганизмов в поддержании экологического равновесия на планете и их использовании при осуществлении биологического контроля за загрязнением биосферы. Основными задачами курса являются:
1. ознакомление с научными основами, особенностями, принципами и задачами санитарно-микробиологических исследований, проводимых в единой системе экологического мониторинга;
2. изучение основных контролируемых показателей бактериального загрязнения экосистем, методов проведения санитарно-микробиологических исследований, нормативов и критериев оценки качества окружающей среды по микробиологическим показателям;
3. углубление и расширение представлений об инфекции, ее источниках, возбудителях некоторых наиболее распространенных инфекционных заболеваний человека и животных, путях их передачи, о значении состояния окружающей среды в распространении инфекционных заболеваний, о мерах профилактики.
Предлагаемый текст лекций является лишь частью читаемого курса, в него не вошел большой и очень важный раздел, касающийся санитарной микробиологии продуктов питания. Материал изложен с учетом последних изменений ныне действующих и вновь принятых нормативных документов (ГОСТов, СанПиНов, приказов Министерства здравоохранения РФ и Главного санитарного врача РФ, и др.) в области санитарно-гигиенического законодательства. Приобретенные знания могут быть использованы студентами при изучении смежных дисциплин экологического цикла, а также при выполнении курсовых и дипломных работ.
Общая часть
Тема 1. Санитарная микробиология как наука
1.1. Предмет и задачи санитарной микробиологии
Санитарная микробиология — наука, изучающая микроорганизмы окружающей среды и вызываемые их жизнедеятельностью процессы, которые могут непосредственно или косвенно оказывать неблагоприятное воздействие на здоровье людей и окружающую среду.
Микроорганизмы окружающей среды и их влияние на здоровье человека и является предметом изучения санитарной микробиологии. К таким микроорганизмам относятся:
— патогенные и условно-патогенные;
— поражающие хозяйственно важные виды животных;
— вызывающие порчу пищевых продуктов.
В ряде случаев санитарная микробиология изучает микроорганизмы, вызывающие разрушение сооружений или препятствующие деятельности коммунальных и промышленных предприятий, что также отражается на здоровье населения и состоянии окружающей среды.
Задачи современной санитарной микробиологии могут быть сформулированы следующим образом:
1. Разработка, совершенствование и оценка методов микробиологических исследований объектов окружающей среды — воды, почвы, воздуха, предметов обихода, а также пищевых продуктов.
2. Выработка нормативов, определяющих соответствие микробных ценозов исследуемых объектов гигиеническим требованиям; совершенствование санитарного законодательства, способствующего охране объектов окружающей среды от загрязнения.
3. Оценка путей воздействия человека и животных на окружающую среду. Эта проблема интересует санитарных микробиологов прежде всего потому, что человек и животные являются источниками загрязнения окружающей среды как патогенными, так и другими разнообразными микроорганизмами. При оценке путей воздействия особое внимание уделяется изучению:
— нарушений процессов естественного самоочищения различных объектов окружающей среды, вызванных деятельностью человека;
— природных процессов регуляции микробного населения почвы, воды, воздуха.
4. Разработка рекомендаций по оздоровлению объектов окружающей среды и контроль за эффективностью проводимых мероприятий. Это, в частности, предупредительный и текущий санитарный надзор. Предупредительный санитарный надзор необходим при проектировании и строительстве различных предприятий, при выборе источников водоснабжения, и т.д. Текущий санитарный надзор — непрерывный контроль за качеством водоснабжения, работой пищевой сети, эффективностью обеззараживания сточных вод, и т.п.
5. Охрана окружающей среды. Эта задача вытекает из всех предыдущих задач санитарной микробиологии, поскольку здоровье человека напрямую зависит от качества окружающей среды.
1.2. Краткая история становления санитарной микробиологии как науки. Государственная санитарно-эпидемиологическая служба РФ
Выделение санитарной микробиологии в самостоятельную дисциплину связано с особенностями разрабатываемых ею проблем, своеобразием используемых методических приемов и особыми задачами, которые она призвана решать.
Началом развития санитарной микробиологии можно считать 1888 год, когда французский врач Е. Mace предложил считать кишечную палочку показателем фекального загрязнения воды. Формирование санитарной микробиологии сначала в качестве отрасли гигиены[1], а затем и как самостоятельной науки происходило главным образом в нашей
стране. За рубежом литература по отдельным проблемам санитарной микробиологии публикуется обычно в специальных изданиях, посвященных коммунальному делу, пищевой санитарии или прикладным вопросам микробиологии.
В нашей стране, начиная с 30-х годов двадцатого столетия, предпринимались попытки собрать рассеянные сведения воедино и создать стройную научную систему в этой области. Развитие отечественной санитарной микробиологии связано, прежде всего, с именами Александра Александровича Миллера. Ивана Евгеньевича Минкевича, Вениамина Израилевича Теца, опубликовавших в 1935-1953 годах первые в мире учебники, охватившие все основные разделы санитарной микробиологии. В настоящее время санитарная микробиология – самостоятельная наука, стоящая на стыке микробиологии, гигиены и эпидемиологии[1]. Она в равной степени необходима специалистам разных профилей. В стране работает ряд специализированных научно-исследовательских институтов, которые вносят большой вклад в развитие санитарной микробиологии. Это ГУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН, ГУ Московский НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского, ГУ НИИ вирусологии им. Д.И. Ивановского, ГУ Центральный НИИ эпидемиологии, ФГУ Российский научно-исследовательский противочумный институт «Микроб» и др.
Немалый вклад в развитие санитарной микробиологии вносит государственная санитарно-эпидемиологическая служба РФ. Центры государственного санитарно-эпидемиологического надзора различного уровня и существующие при них санитарно-бактериологические лаборатории являются в настоящее время основными практическими учреждениями, осуществляющими государственный санитарный надзор за соблюдением норм и правил, а также за проведением всех необходимых мероприятий по профилактике заболеваний и оздоровлению окружающей среды.
Днем рождения государственной санитарно-эпидемиологической службы Российской Федерации считается 15 сентября 1922 года. Именно в этот день был принят Декрет Совета Народных Комиссаров РСФСР «О санитарных органах Республики» — важнейший документ, заложивший основу создания в России государственной системы обеспечения охраны здоровья населения страны. С этого времени началось ее становление, формирование целей и задач. Неоценимый вклад внесли санитарные организации в борьбу с грозными эпидемиями паразитарных тифов, холеры, натуральной оспы, малярии, других опасных инфекционных заболеваний, бушевавших в стране в начале XX века.
В 1991-1992 годах государственная санитарно-эпидемиологическая служба получила статус единой федеральной централизованной системы органов и учреждений, объединившей на функциональной основе государственные санитарно — эпидемиологические службы министерств и ведомств — Минздрава России, МПС России, Минобороны России, Минюста России, ФПС России, ФСБ России, ФСНП России, и др.
В апреле 1991 года был принят Закон РСФСР «О санитарно-эпидемиологическом благополучии населения». Впервые в отечественной истории на законодательном уровне введено регулирование общественных отношений в сфере обеспечения санитарно-эпидемиологического благополучия населения. Впоследствии Государственной Думой РФ был принят Федеральный закон от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
[1] Эпидемиология (греч. epidemia — повальная болезнь logos — учение) – это наука о массовых заболеваниях людей, изучающая причины и условия формирования заболеваемости и разрабатывающая мероприятия по профилактике и борьбе с эпидемиями.
Под санитарно-эпидемиологическим благополучием населения понимают состояние здоровья населения и среды обитания человека, при котором отсутствует вредное воздействие факторов среды на человека и обеспечиваются благоприятные условия его жизнедеятельности.
Основными органами, выполняющими функции по предупреждению, обнаружению и пресечению нарушений санитарного законодательства РФ и обеспечению санитарно-эпидемиологического благополучия населения, являются органы и учреждения государственной санитарно-эпидемиологической службы РФ. Они осуществляют государственное санитарно-эпидемиологическое нормирование, государственный санитарно-эпидемиологический надзор, проведение социально-гигиенического мониторинга и ряд других функций. Основными задачами службы являются: профилактика инфекционных и массовых неинфекционных заболеваний населения РФ, предупреждение вредного влияния неблагоприятных условий труда, быта, факторов окружающей среды на здоровье человека; гигиеническое воспитание и образование населения.
В настоящее время нормативно-правовой базой обеспечения санитарно-эпидемиологического благополучия населения являются:
— «Основы законодательства Российской Федерации об охране здоровья населения» (1993);
Федеральные законы:
— «О санитарно-эпидемиологическом благополучии населения» (1991, 1999);
— «О предупреждении распространения в Российской Федерации заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ-инфекции)» (1995);
— «Об иммунопрофилактике инфекционных болезней» (1998);
— «О качестве и безопасности пищевых продуктов» (2000);
— «О предупреждении распространения туберкулеза в РФ» (2001);
а также:
— «Трудовой кодекс РФ» (2001);
— «Кодекс РФ об административных правонарушениях» (2001);
— ряд других федеральных законов и постановлений Правительства РФ.
В рамках системы государственного санитарно-эпидемиологического нормирования действует более 12 тысяч норм, правил и нормативов. Ведется систематическая работа со странами СНГ по взаимопризнанию нормативных и методических документов в сфере обеспечения санитарно-эпидемиологического благополучия населения. В качестве международных признаны более 50 санитарных норм и правил.
1.3. Принципы санитарно-микробиологических исследований
При проведении санитарно-микробиологических исследований необходимо руководствоваться следующими принципами:
1. Правильное взятие проб.
Отбор проб для санитарно-микробиологических исследований должен проводиться с соблюдением правил стерильности и всех необходимых условий, регламентированных для каждого исследуемого объекта соответствующими нормативными документами (ГОСТ, ОСТ, ГН, МУК[1], инструкции). Ошибки, допущенные при взятии проб, приводят к получению неправильных результатов. При упаковке и транспортировке проб необходимо создавать условия, исключающие гибель или размножение исходной микробиоты в исследуемом объекте. Поэтому отобранные пробы должны быть как можно быстрее доставлены в лабораторию для исследования, при невозможности быстрой доставки допускается сохранение материала в холодильных камерах не более 6-8 часов. Каждая проба сопровождается документом, в котором указывают название исследуемого материала, номер пробы, время и место взятия, дают краткую характеристику объекта. На документе должна быть подпись лица, взявшего пробу.
2. Осуществление серийных анализов.
Применение этого принципа обусловлено тем, что распределение микроорганизмов в загрязненных объектах, как правило, неравномерно, поэтому отбор возможно большего количества проб из разных участков объекта позволяет получить более достоверную характеристику объекта. Доставленные в лабораторию пробы смешивают и анализируют среднюю пробу.
3. Повторное взятие проб.
Необходимость этого связана, прежде всего, с тем, что многие объекты внешней среды (вода, воздух) весьма динамичны, сменяемость микробиоты во времени и пространстве очень велика. Поэтому повторный отбор проб из разных участков объекта и в разное время позволяет не только получить пространственную и динамическую характеристику объектов окружающей среды, но и более точно определить их биологическую контаминацию[2].
4. Применение стандартных методов.
Стандартизация методов делает результаты исследований легко сравнимыми, достаточно полными и в то же время гарантирует от грубых ошибок. Методы исследования регламентированы для каждого исследуемого объекта соответствующими нормативными документами (ГОСТ, МУК и др.).
5. Одновременное использование комплекса тестов: наиболее
чувствительных прямых методов и комбинированных (количественных и качественных) косвенных методов.
Использование комплекса тестов обеспечивает получение разносторонней санитарно-микробиологической характеристики объекта и позволяет выявить отклонения от нормы. Более подробно методы санитарно-микробиологических исследований будут рассмотрены далее.
6. Оценка объектов по совокупности санитарно-микробиологических тестов с учетом прочих гигиенических показателей на основе узаконенных нормативов.
Соблюдение этого принципа необходимо потому, что развитие микроорганизмов происходит в тесной взаимосвязи с другими факторами окружающей среды, которые могут оказывать как благоприятное, так и неблагоприятное влияние на их размножение. При оценке объектов по совокупности показателей необходимо иметь в виду следующее:
[1] ГОСТ – государственный стандарт; ГН – гигиенический норматив; ОСТ – отраслевой стандарт; МУК – методические указания.
— во-первых, резкое отклонение микробиологических показателей от нормы даже при благоприятном уровне всех остальных характеристик должно считаться достаточным основанием для неблагоприятной оценки объекта;
— во-вторых, в ряде случаев благоприятные санитарно-микробиологические показатели не гарантируют безопасности объекта, так как микроорганизмы воздействуют на организм в комплексе с другими факторами.
Поэтому большинство стандартов включает микробиологические нормы как один из элементов, характеризующих рассматриваемые объекты. Оценку объектов проводят в соответствии с установленными ГОСТами, ОСТами, ГН, СанПиНами, СП[1], специальными техническими регламентами.
[1] СанПиН – санитарные правила и нормативы: СП – санитарные правила.
1.4. Структура современной санитарной микробиологии
Структуру современной санитарной микробиологии наглядно можно представить в виде двух больших блоков, в каждом из которых изучается определенный круг вопросов (рис. 1). Курс лекций по «Санитарной микробиологии» предполагает последовательное рассмотрение всех перечисленных вопросов обоих блоков.
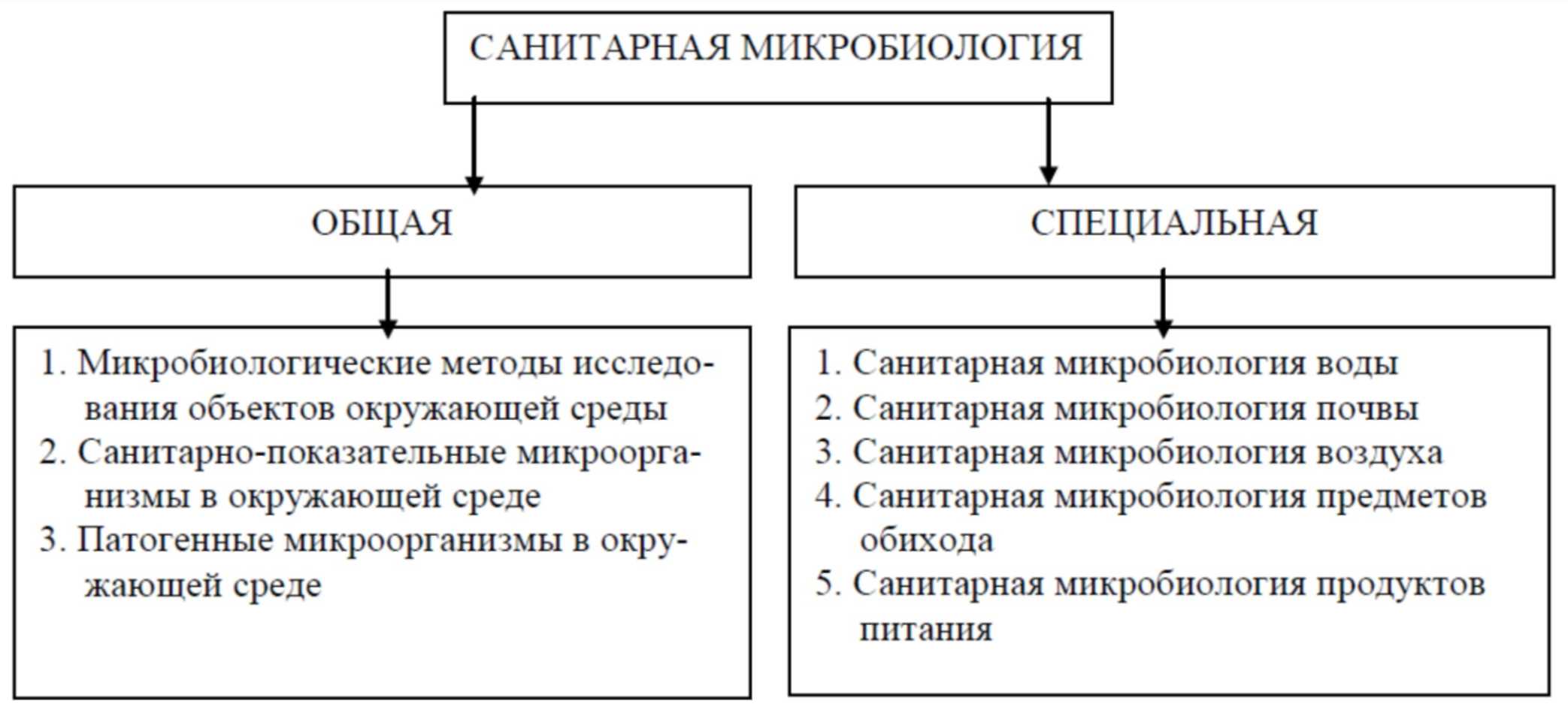
Рис. 1. Структура современной санитарной микробиологии
1.5. Методы исследования объектов окружающей среды, применяемые в санитарной микробиологии
Все санитарно-микробиологические методы можно разделить на две большие группы: прямые и косвенные методы (рис. 2).
Прямые методы — это методы непосредственного обнаружения патогенных микроорганизмов в окружающей среде.
Однако прямое выявление патогенных микроорганизмов сопряжено с рядом трудностей, связанных, прежде всего, с низкой концентрацией данных микроорганизмов, которые, как правило, не могут размножаться в воздухе, воде и почве. Поэтому в санитарно-микробиологических исследованиях в основном применяют косвенные методы, указывающие на возможное присутствие патогенных микроорганизмов.
Косвенныеметоды могут быть качественными и количественными. Качественные устанавливают лишь факт наличия или отсутствия микроорганизмов в исследуемом объекте. Количественные методы позволяют определить степень микробного загрязнения объектов окружающей среды и, следовательно, их потенциальную опасность для здоровья человека.
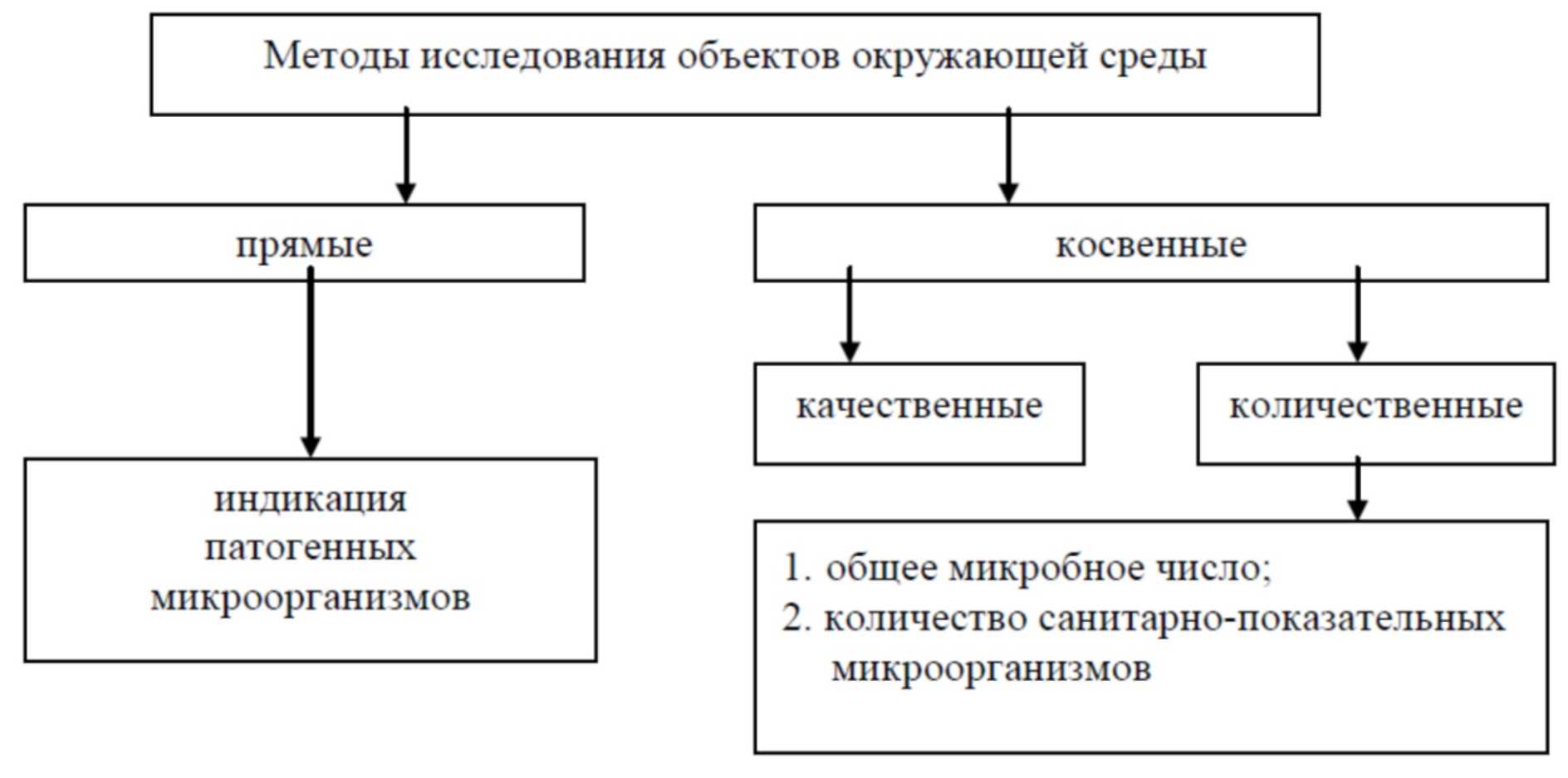
Рис. 2. Методы санитарно-микробиологических исследований
К косвенным количественным методам относят:
— определение общего микробного числа (или общей микробной обсемененности, или общего количества бактерий);
— количественный учет санитарно-показательных микроорганизмов.
Общее микробное число (ОМЧ)
Общее микробное число (ОМЧ) — количество микроорганизмов в единице объема исследуемого объекта. Выражается в кл/мл, кл/г, кл/м3 или КОЕ[1]/мл, КОЕ/г, КОЕ/м3.
При определении ОМЧ исходят из предположения, что, чем оно больше, тем выше вероятность попадания в объект патогенных микроорганизмов. Определение ОМЧ должно проводиться с соблюдением определенных правил: пробы, взятые асептично из разных участков исследуемого объекта, или средние пробы должны транспортироваться в лабораторию в условиях, исключающих добавочное загрязнение, а также размножение или отмирание микроорганизмов. В лаборатории пробы гомогенизируют, затем отмеряют определенные весовые или объемные количества материала и подвергают его исследованию.
Существует два метода определения ОМЧ: метод прямого подсчета и метод количественного посева различных разведений образцов и проб исследуемого материала на питательные среды.
1. Прямой подсчет проводят под микроскопом, используя:
— специальные счетные камеры (для крупных объектов — дрожжей, конидий грибов, некоторых относительно крупных бактерий);
— препараты фиксированных и окрашенных клеток, приготовленные на предметных стеклах (широко используется для определения численности микроорганизмов в различных естественных субстратах);
— окрашенные мембранные фильтры, через которые пропускают исследуемую жидкость или взвесь (рекомендуется использовать для оценки численности микроорганизмов в субстратах с низкой плотностью клеток).
Метод применяется в экстренных случаях, когда необходимо срочно дать ответ о количественном содержании бактерий, например при авариях в системе водоснабжения, и т.п. Метод кажется простым и удобным, однако имеет ряд недостатков, снижающих его ценность, и из-за этого редко используется.
Недостатки метода:
— методически невозможно точное определение общего количества микроорганизмов, так как часто они образуют скопления или «прилипают» к частицам исследуемого субстрата;
— трудно подсчитывать мелкие клетки;
— часто микробные клетки бывают трудноотличимы от примесей иной природы;
— устанавливается суммарное число живых и мертвых клеток, хотя они имеют различное санитарное значение;
— критерий имеет ограниченное значение, так как применим не ко всем объектам (например, кисломолочные продукты, приготовленные путем целенаправленного внесения специальных заквасочных культур микроорганизмов).
Применение специальных люминесцирующих красителей, позволяющих отличать живые клетки от мертвых и от частичек субстрата, делает этот метод более перспективным.
2. Количественный посев различных разведений образцов и проб исследуемого материала на плотные питательные среды (чашечный метод Коха) применяется наиболее часто.
Для этого сначала, в зависимости от предполагаемой степени загрязнения исследуемого объекта, готовят серию десятикратных разведений отобранных образцов, а затем высевают определенные объемы из каждого разведения (как правило, по 1 мл) на плотную питательную среду. После инкубации подсчитывают число выросших колоний и, с учетом разведений, определяют количество жизнеспособных микроорганизмов в единице объема исследуемого объекта.
Недостатком метода является его неточность, поскольку получаемые цифры значительно ниже истинного количества микроорганизмов в исследуемом объекте. Объясняется это несколькими причинами:
— потребности микроорганизмов в питательных веществах разнообразны, поэтому невозможно подобрать универсальную среду, на которой вырастали бы все группы микроорганизмов;
— режим инкубации не соответствует требованиям всех микроорганизмов в ассоциации;
— не дают роста микроорганизмы, находящиеся в комочках исследуемого объекта, а если и наблюдается рост колоний, то, возможно, не из одной клетки;
— часть микроорганизмов теряет способность к размножению в силу антагонизма, конкуренции и других причин.
Обычно в практике санитарно-микробиологических исследований в качестве питательной среды используют мясопептонный или рыбопептонный агар (МПА, РПА), при этом выявляют лишь мезофильных аэробных и факультативно-анаэробных бактерий, способных размножаться на данных средах. Однако и в этом случае высокий показатель ОМЧ указывает на низкий санитарный уровень исследуемого объекта.
Таким образом, оба метода определения ОМЧ являются приблизительными. Для получения сравнимых результатов определение ОМЧ проводят по стандартным методикам, регламентированным для каждого объекта соответствующими нормативными документами.
ОМЧ является очень важным показателем при обследовании посуды, столовых приборов, рук, а также готовых блюд, особенно при проверке правильности термической обработки или условий хранения.
[1] КОЕ – колониеобразующая единица.
Количественный учет санитарно-показательных микроорганизмов
Обнаружение санитарно-показательных микроорганизмов является косвенным показателем биологической контаминации окружающей среды патогенными микроорганизмами. Количественный их учет дает возможность предполагать присутствие тех или иных патогенных микробов. Для количественных анализов применяют различные методики:
1. Определение титра.
Титр — это наименьшее количество исследуемого материала (в миллилитрах — для жидких субстратов или в граммах — для твердых), в котором обнаружена хотя бы одна жизнеспособная клетка искомого микроорганизма.
Например:
— «коли-титр» — наименьшее количество исследуемого материала, в котором обнаружена хотя бы одна жизнеспособная клетка бактерий группы кишечных палочек;
— «перфрингенс-титр» — наименьшее количество исследуемого материала, в котором обнаружена хотя бы одна жизнеспособная клетка бактерий, относящихся к виду Clostridium perfringens.
2. Определение индекса.
Индекс — количество клеток искомого микроорганизма, содержащихся в определенном объеме (массе) исследуемого объекта: для воды и жидких продуктов — в 1 000 мл, для почвы и твердых пищевых продуктов — в 1 г.
Например, «коли-индекс» — число бактерий группы кишечных палочек в 1 000 мл воды, 1 г почвы или 1 г твердого пищевого продукта.
Индекс – величина, обратная титру, поэтому пересчет титра в индекс и обратно можно производить по формулам:
для воды и жидких продуктов:

Так, например, в соответствии с ГОСТом 2874-82 «Вода питьевая. Гигиенические требования и контроль за качеством», коли-индекс питьевой воды должен быть не более 3. Это означает, что в питьевой воде количество клеток бактерий группы кишечных палочек не должно превышать 3 кл в 1 л. Соответственно, коли-титр питьевой воды должен быть не менее 333, т.е. по стандарту допускается присутствие 1 клетки бактерий группы кишечных палочек не менее чем в 333 мл воды.
Обычно при посеве на плотные среды определяют индекс, а при посеве в жидкие среды — титр, хотя всегда титр может быть переведен в индекс и обратно.
3. Количественный учет микроорганизмовв различных объемах (массах) исследуемых объектов, которые определены санитарно-гигиеническими нормативами.
Например, согласно СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения» в питьевой воде количество ОКБ и ТКБ определяют в 100 мл, споры сульфитредуцирующих клостридий – в 20 мл.
Количественный учет того или иного санитарно-показательного микроорганизма, как и ОМЧ, проводят по стандартным для каждого объекта методикам, регламентированным соответствующими ГОСТами, МУКами и т.п.
Индикация патогенных микроорганизмов
Как уже было сказано, прямая индикация патогенных микроорганизмов сопряжена с рядом трудностей. Это связано, прежде всего, с низкой концентрацией данных микроорганизмов в окружающей среде, так как они, как правило, не могут размножаться в воздухе, воде и почве. Поэтому прямой поиск патогенных микроорганизмов используется лишь в тех случаях, когда имеются классические методы обнаружения малых количеств патогенных микроорганизмов и их токсинов, например, при индикации возбудителей чумы (Pasteurella pestis), холеры (Vibrio cholerae), при обнаружении токсинов ботулизма и др. В этих случаях сначала проводят концентрирование патогенов или их токсинов из исследуемого материала путем посевов на элективные[1] питательные среды, а при необходимости и возможности проводят заражение животных. При получении чистой культуры проводят ее идентификацию по определенной схеме.
[1] Элективные (накопительные, селективные) питательные среды — специфические питательные среды, удовлетворяющие потребности преимущественно одной группы микроорганизмов. Предназначены для выделения микроорганизмов из мест их естественного обитания.
Тема 2. Учение о санитарно-показательных микроорганизмах
2.1. Общая характеристика санитарно-показательных микроорганизмов, предъявляемые к ним требования
Санитарно-микробиологическое исследование объектов окружающей среды призвано решить вопрос о наличии или отсутствии в них микроорганизмов — возбудителей инфекционных болезней человека, т.е. оценить окружающую среду с точки зрения эпидемической (без)опасности. Выше уже было сказано о том, что непосредственное обнаружение опасных для человека микроорганизмов (прямая индикация) сопряжено с рядом трудностей, поэтому, как правило, оценку различных объектов окружающей среды проводят по косвенным показателям с использованием группы так называемых санитарно-показательных микроорганизмов.
К санитарно-показательным микроорганизмамотносят представителей облигатной микробиоты человека и животных, обитающих в кишечнике или респираторном тракте.
Кишечник и респираторный тракт, т.е. сообщающиеся с внешним миром полости организма человека и животных, обильно заселены микроорганизмами — представителями так называемой нормальной микробиоты[1], которая в норме довольно постоянна по качественному составу. Для многих из них полость кишечника или респираторный тракт являются единственным природным биотопом, хотя при некоторых условиях они могут определенное время сохранять жизнеспособность вне организма, а в ряде случаев (например, в пищевых продуктах) даже размножаться. С экскретами организма обитатели кишечника или респираторного тракта попадают во внешнюю среду, поэтому их обнаружение вне организма свидетельствует:
— во-первых, о загрязнении различных объектов соответствующими выделениями человека или животных;
— во-вторых, косвенно указывает на возможное присутствие патогенных микробов, выделяющихся из организма теми же путями.
Так, например:
— обнаружение нормальных обитателей кишечника свидетельствует о наличии фекального загрязнения и возможной опасности присутствия возбудителей брюшного тифа, дизентерии и других кишечных инфекций;
— представители нормальной микробиоты респираторного тракта во внешней среде указывают на ее воздушно-капельное загрязнение и возможность присутствия возбудителей дифтерии, скарлатины, туберкулеза и пр.
В таких случаях представители нормальной микробиоты служат показателем санитарного неблагополучия, потенциальной опасности исследуемых объектов, поэтому они и получили название санитарно-показательные.
Количественный учет санитарно-показательных микроорганизмов во внешней среде позволяет установить степень ее загрязнения, что в свою очередь определяет степень эпидемической опасности исследуемых объектов: чем больше в них обнаруживается санитарно-показательных микроорганизмов, тем выше вероятность наличия здесь патогенных микроорганизмов, выделяющихся теми же путями.
[1] В литературе для обозначения микроорганизмов — обитателей организма человека и животных до сих пор встречается широко применявшийся ранее термин «микрофлора».
Санитарно-показательные микроорганизмы должны обладать рядом свойств, совокупность которых определяет их ценность и санитарно-показательную значимость. Перечислим эти свойства.
1. Санитарно-показательные микроорганизмы должны выделяться во внешнюю среду постоянно и в больших количествах.
2. Пребывание санитарно-показательных микроорганизмов в объектах внешней среды должно совпадать или несколько превышать по времени длительность выживания в той же среде соответствующих патогенных микробов.
3. У санитарно-показательных микроорганизмов должна отсутствовать или быть ограниченной способность размножаться во внешней среде, в противном случае ценность их как показателей фекального или воздушно-капельного загрязнения резко снижается или полностью утрачивается.
4. Легкость обнаружения даже в малых количествах и сравнительно быстрая и четкая идентификация при помощи несложных методов. Во внешней среде не должно быть сапротрофов-аналогов, сходство с которыми потребовало бы сложных и длительных по времени, а также многочисленных приемов дифференцирования.
5. У санитарно-показательных микроорганизмов должна отсутствовать рано проявляющаяся и далеко идущая изменчивость. Широкая и рано наступающая изменчивость кишечной палочки (Escherichia coli) — наиболее популярного санитарно-показательного микроорганизма — значительно снижает ее ценность, особенно при исследовании объектов, подвергающихся тем или иным химическим или физическим воздействиям, индуцирующим эту изменчивость.
6. Санитарно-показательные микроорганизмы не должны иметь других мест обитания, кроме организма человека или теплокровных животных.
Приведенный перечень требований вряд ли может быть реализован во всей совокупности, однако, чем большему их количеству удовлетворяет тот или иной микроорганизм, тем более ценен он в качестве санитарно-показательного.
2.2. Группы санитарно-показательных микроорганизмов
Все микроорганизмы, относящиеся к категории санитарно-показательных, можно разделить на три группы: показатели (индикаторы) фекального загрязнения, воздушно-капельного загрязнения и загрязнения объектов внешней среды разлагающимися органическими субстратами (рис. 3).
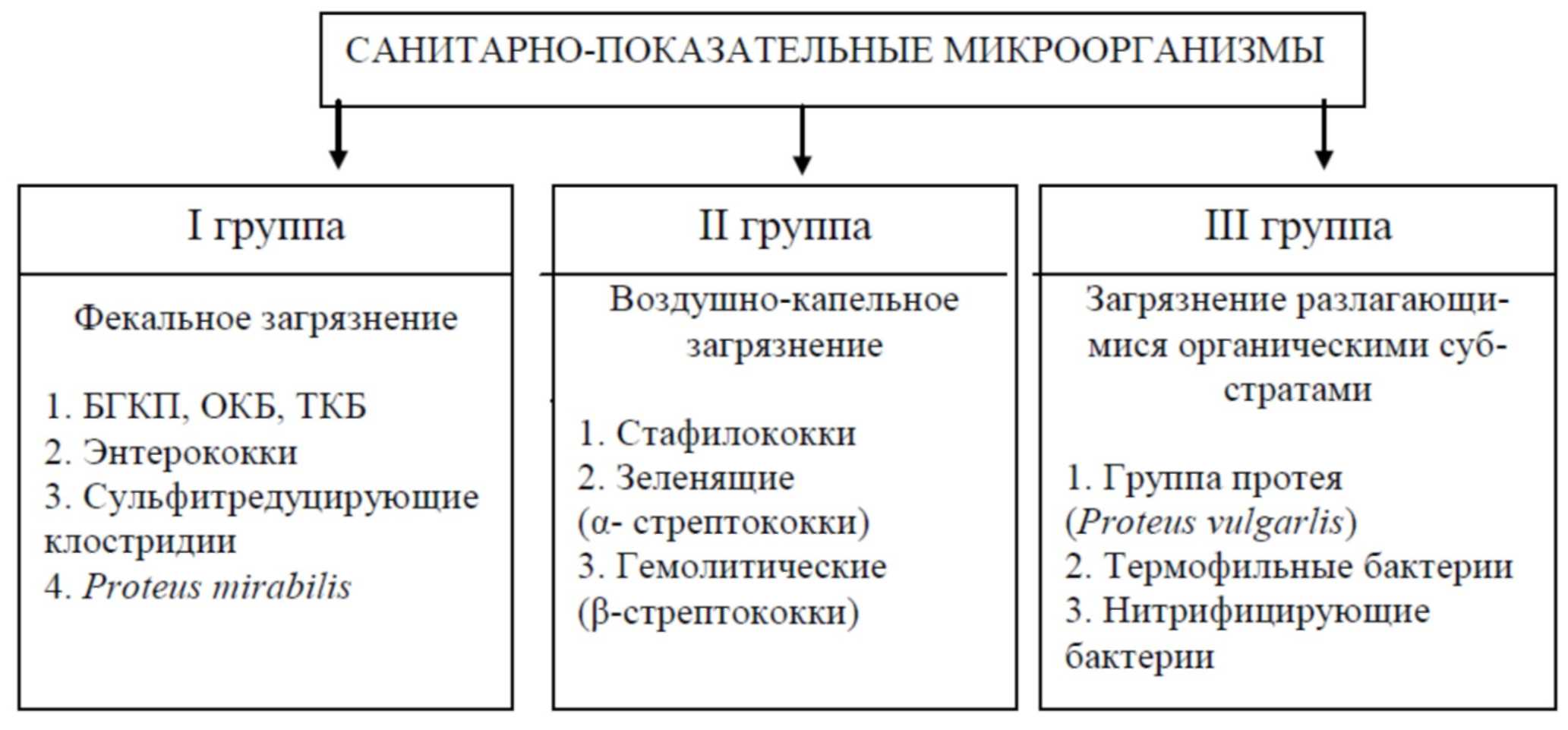
Рис. 3. Группы санитарно-показательных микроорганизмов
Представители первых двух групп являются обитателями естественных полостей организма человека и теплокровных животных.
I группа — представители нормальной микробиоты кишечника, поэтому они указывают на фекальное загрязнение объектов окружающей среды и свидетельствуют тем самым о возможном присутствии в этих объектах возбудителей кишечных инфекций и токсикоинфекций.
II группа — представители нормальной микробиоты верхних отделов дыхательных путей, поэтому они являются показателями биологической контаминации воздуха и других объектов окружающей среды обитателями респираторного тракта человека и теплокровных животных. В этом случае говорят о воздушно-капельном загрязнении. Служат для косвенной индикации в объектах внешней среды возбудителей инфекций, передающихся воздушно-капельным и воздушно-пылевым путем.
Кроме этого, в настоящее время выделяют еще III группу, в которой в качестве представителей используются микроорганизмы, обитающие в естественных условиях вне организма человека или животных. Это обусловлено все возрастающим загрязнением окружающей среды различными органическими веществами и необходимостью контроля процессов естественного самоочищения от органического загрязнения.
2.3. Краткая характеристика отдельных представителей санитарно-показательных микроорганизмов
БАКТЕРИИ ГРУППЫ КИШЕЧНЫХ ПАЛОЧЕК
Под общим названием «Бактерии группы кишечных палочек» (БГКП) объединяют бактерии семейства Еnterobacteriaceae (энтеробактерии), которое в соответствии с Определителем бактерий Берджи (1997) входит в группу 5 «Факультативно анаэробные грамотрицательные палочки».
В соответствии с ГОСТом 18963-73 «Вода питьевая. Методы санитарно-бактериологического анализа» к БГКП относят: грамотрицательные[1], не образующие спор палочки, сбраживающие лактозу с образованием кислоты и газа при температуре 37±0,5°С в течение 24-48 часов или сбраживающие глюкозу с образованием кислоты и газа при температуре 37±0,5°С в течение 24 часов и не обладающие оксидазной активностью[2].
Для обнаружения БГКП сначала делают посев исследуемого материала на дифференциально-диагностическую среду Эндо (в качестве источника углерода она содержит лактозу). В соответствии с ГОСТом все бактерии, дающие рост на среде Эндо при температуре 37±0,5°С в течение 24 часов, получили название эндобактерий.
Эндобактерии представлены, в основном, грамотрицательными микроорганизмами, но на среде Эндо могут вырастать и колонии, содержащие грамположительные бактерии. Поэтому из эндобактерий выделяют энтеробактерии — грамотрицательные эндобактерии, не образующие спор и являющиеся оксидазоотрицательными.
[1] Окраска по Граму — метод окраски бактериальных клеток, который является важным диагностическим признаком. Способность бактерий окрашиваться по Граму связывают с их молекулярной организацией и химическим составом клеточной стенки. По способности окрашиваться красителями триметилфенолового ряда всех бактерий делят на две группы: грамположитeльныe и грамотрицательные.
[2] Оксидазная активность — наличие в клетках ферментов — оксидаз (аэробных дегидрогеназ), которые передают водород от субстрата непосредственно кислороду.
Из энтеробактерий в свою очередь выделяют БГКП — бактерии, обладающие дополнительным свойством сбраживать глюкозу с образованием кислоты и газа при температуре 37±0,5°С в течение 24 часов. Эту группу учитывают как БГКП по ГОСТ 2874-82 «Вода питьевая. Гигиенические требования и контроль за качеством».
Среди БГКП выделяют лактозоположительные палочки (ЛКП), которые в соответствии с международной классификацией относят к колиформным бактериям. В настоящее время показатель БГКП приведен в соответствие с международной номенклатурой и практически идентичен показателю «колиформные бактерии».
Согласно Методическим указаниям МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды» среди колиформных бактерий различают общие колиформные бактерии и термотолерантные колиформные бактерии.
Общие колиформные бактерии (ОКБ) — грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре 37±1°С в течение 24-48 ч.
Термотолерантные колиформные бактерии (ТКБ) — входят в число ОКБ, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре 44±0,5°С в течение 24 ч. Их еще иначе называют фекальными кишечными палочками (ФКП). К этой группе относится Escherichia coli — типичный обитатель кишечника человека и теплокровных животных. Экспериментально установлено, что при попадании во внешнюю среду E.coli через определенный промежуток времени способна значительно изменять свои ферментативные свойства и приобретать признаки p.p. Citrobacter и Enterobacter. В связи с этим ее присутствие в объектах окружающей среды служит показателем свежего фекального загрязнения.
При обнаружении только ОКБ (или в целом БГКП) и отсутствии ТКБ нельзя однозначно делать вывод о фекальном загрязнении, так как представители группы кишечных палочек распространены также в почве и на растениях. Их присутствие, например, в питьевой воде, может расцениваться как свидетельство:
— недостаточной очистки исходной воды:
— вторичного загрязнения воды после очистки в распределительной сети;
— попадания почвенных вод:
— как вероятность фекального загрязнения.
Тот или иной показатель (БГКП, ОКБ или ТКБ) определяют в зависимости от задач исследования.
ЭНТЕРОКОККИ (ФЕКАЛЬНЫЕ СТРЕПТОКОККИ)
Энтерококки являются представителями нормальной микробиоты кишечника человека и теплокровных животных и выделяются в окружающую среду в довольно значительных количествах (108 — 109 кл/г фекалий).
В соответствии с Определителем Берджи их относят к группе 17 «Грамположительные кокки», р. Enterococcus. Санитарно-показательное значение имеют два вида: Enterococcus faecalis (преобладает в кишечнике человека) и Enterococcus faecium (преобладает в кишечнике животных). Ранее их относили к видам Streptococcus faecalis и Streptococcus faecium. По морфологии энтерококки представляют собой диплококки ланцетовидной, овальной или круглой формы, иногда располагающиеся цепочками, грамположительны, спор не образуют.
Энтерококки принято считать показателями свежего фекального загрязнения, так как они быстро отмирают в окружающей среде (быстрее, чем Е. coli) и не способны в ней размножаться. Однако для выделения энтерококков из окружающей среды требуется больше времени, чем при индикации БГКП, и более сложные в приготовлении питательные среды. Это препятствует широкому их использованию как показателей фекального загрязнения, хотя в стандартах некоторых стран (Россия, Англия, США, Франция и др.) энтерококки признаны дополнительным показателем фекального загрязнения воды.
СУЛЬФИТРЕДУЦИРУЮЩИЕ КЛОСТРИДИИ
Клостридии, так же как энтерококки и кишечные палочки, являются обитателями кишечника человека и некоторых теплокровных животных и выделяются в окружающую среду в количестве от 106 до 109 кл/г фекалий.
В соответствии с Определителем Берджи их относят к группе 18 «Грамположительные палочки и кокки, образующие эндоспоры», роду Clostridium. По морфологии — это довольно крупные (5-8 мкм в длину и 1-2 мкм в ширину) неподвижные полиморфные грамположительные спорообразующие палочки. В организме человека и животных способны образовывать капсулы. Споры термоустойчивы, могут выдерживать кипячение до 2 ч.
Санитарно-показательное значение имеют, главным образом, С. perfringens и С. sporogenes. Они способны редуцировать (восстанавливать) сульфит при росте в сульфитных средах, в связи с чем получили название — сульфитредуцирующие. В соответствии с МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды» к сульфитредуцирующим клостридиям относят спорообразующие анаэробные палочковидные микроорганизмы, редуцирующие сульфит натрия на железо-сульфитном агаре при температуре 44±1° С в течение 16-18 ч.
Сроки выживания этих микробов во внешней среде могут быть довольно длительны, поэтому обнаружение спор сульфитредуцирующих клостридий может свидетельствовать как о свежем (при одновременном наличии ТКБ), так и о давнем фекальном загрязнении. Этот показатель очень важен при исследовании питьевой воды, пищевых продуктов и почвы, так как он косвенно указывает на возможное присутствие патогенных клостридий (таких как С. botulinum – возбудитель ботулизма, С. tetani – возбудитель столбняка). С этой же целью проверяется на наличие спор сульфитредуцирующих ктостридий вода при выборе нового источника водоснабжения, а также вода на предприятиях консервной промышленности. Накопление С. perfringens в почве опасно как потенциальный источник раневой анаэробной инфекции (газовой гангрены). Кроме того, С. perfringens способны размножаться в пищевых продуктах и вызывать тяжелые пищевые токсикоинфекции.
Большим преимуществом санитарно-показательных клостридий перед кишечными палочками является быстрая и технически несложная индикация их в окружающей среде.
БАКТЕРИИ ГРУППЫ ПРОТЕЯ
К бактериям группы протея относят представителей семейства Enterobacteriaceae рода Proteus. В соответствии с Определителем Берджи это семейство входит в группу 5 «Факультативно анаэробные грамотрицательные палочки». Морфологически это грамотрицательные подвижные палочки с перитрихальными жгутиками, 1-3 мкм в длину и 0,4-0,8 мкм в ширину с присущим проявлением полиморфизма[1] в зависимости от условий, спор и капсул не образуют.
Характерной культуральной особенностью бактерий этого рода является способность к роению: на твердых питательных средах они образуют вуалеобразный рост, постепенно закрывая всю поверхность среды.
Микроорганизмы p. Proteus относятся к факультативным обитателям толстого кишечника человека и обнаруживаются лишь у 5-10% здоровых людей, поэтому самостоятельного значения как показатель фекального загрязнения не имеют. Представители этого рода достаточно широко распространены в природе, они обитают в субстратах, в которых протекают аэробные процессы гниения. Благодаря работам Т.П. Калины (1969) было установлено, что существуют выраженные экологические различия между видами P. mirabilis и Р. vulgaris. P. mirabilis чаще содержится в хозяйственно-бытовых сточных водах, а P. vulgaris – в сточных водах пищевой промышленности, богатых органическими веществами. В связи с этим P. mirabilis может служить дополнительным показателем фекального загрязнения, а P. vulgaris — показателем загрязнения разлагающимися пищевыми органическими субстратами (рис. 3).
Обнаружение большого количества бактерий вида P. vulgaris в объектах внешней среды свидетельствует о развитии в них гнилостных процессов. Анализ на присутствие этого микроорганизма проводят при санитарно-микробиологическом исследовании пищевых продуктов для выявления их порчи. Кроме того, определение протея проводят для оценки санитарного состояния водоемов в местах сброса сточных вод пищевой промышленности, санитарного состояния почв при загрязнении их органическими отходами, а также при санитарно-микробиологическом исследовании предметов обихода (особенно столовых приборов). Чаще всего выявление и учет бактерий группы протея проводят по эпидемическим показаниям, при этом видовое определение не проводят.
СТАФИЛОКОККИ
Стафилококки относятся к факультативным, но очень часто обнаруживаемым обитателям организма человека и некоторых теплокровных животных. В соответствии с Определителем Берджи их относят к группе 17 «Грамположительные кокки», роду Staphylococcus.
По морфологии стафилококки представляют собой грамположительные, неподвижные клетки сферической формы, диаметром 0,5 -1,5 мкм, одиночные, в парах и в группах неправильной формы (греч. staphylos – гроздь). Основным местом локализации стафилококков служат слизистые оболочки верхних дыхательных путей, а также кожные покровы. В окружающую среду — воздух, на предметы обихода — стафилококки попадают со слюной и мокротой при разговоре, кашле, чихании, а также с кожи, из мест воспалений и раневых поверхностей. При высыхании выделений из носоглотки находившиеся в них стафилококки могут распространяться воздушно-пылевым путем. Загрязнение воды водоемов стафилококками происходит при купании людей.
В организме человека доминируют три вида: коагулазоположительный[1] (S. aureus) и коагулазонегативные (S. epidermidis и S. saprophyticus). Наибольшую роль в патологии
[1] Коагулазоположительные — образуют фермент коагулазу, вызывающую свертывание плазмы крови.
[1] Способность бактерий изменять свою форму и послужила основанием для названия рода. Мифический бог Протей — бог, способный менять свой облик.
человека играет Staphylococcus aureus — золотистый стафилококк, он же является санитарно-показательным. Во внешней среде S. aureus не размножается (за исключением пищевых продуктов), однако обладает большой устойчивостью к различным химическим и физическим факторам. Сроки выживания стафилококков во внешней среде могут доходить до 2-3 месяцев в зависимости от температуры, влажности, воздействия солнечного света и др. Поэтому обнаружение в окружающей среде коагулазоположительных стафилококков следует расценивать как показатель воздушно-капельного загрязнения.
Стафилококков предложено применять в качестве санитарно-показательных микроорганизмов для воздуха закрытых помещений, особенно хирургических, детских стационаров, в отделениях реанимации, родильных отделениях. Увеличение количества санитарно-показательных стафилококков в воздухе, на предметах обихода перечисленных лечебных учреждений свидетельствует о санитарном неблагополучии, а в ряде случаев — и об эпидемиологической опасности (внутрибольничные инфекции).
Стафилококки также являются важным показателем загрязненности воды в зонах рекреации водоемов, плавательных бассейнов.
Преимущество стафилококков как санитарно-показательных микроорганизмов по сравнению со стрептококками заключается в более простой и быстрой индикации стафилококков в окружающей среде, их неприхотливости к питательным средам, высокой резистентности.
СТРЕПТОКОККИ
Стрептококки являются представителями нормальной микробиоты верхних дыхательных путей человека и теплокровных животных. Они постоянно и в большом количестве (до 107 кл/мл слюны) присутствуют в полости рта, носу и носоглотке как больных, так и здоровых людей, и поэтому обильно выделяются в окружающую среду при разговоре, кашле, чихании и т.п.
В соответствии с Определителем Берджи их относят к группе 17 «Грамположительные кокки», роду Streptococcus. Морфологически стрептококки представляют собой круглые или слегка овальные кокки диаметром 0,5-2 мкм, грамположительные, спор не образуют, неподвижные, располагаются цепочками (греч. streptos — скрученный в виде цепи).
В зависимости от способности разрушать эритроциты стрептококков делят на 3 группы:
— α (альфа) -стрептококки (α-гемолитические, зеленящие), — не полностью разрушают эритроциты, образуют зеленоватые зоны вокруг колоний при росте на кровяном агаре). Строго говоря, это не гемолиз, а транс формация гемоглобина в метгемоглобин. К этой группе относятся, например, стрептококки ротовой полости S. mutans (главный возбудитель кариеса), S. sanguis и др.
— ß (бета) -стрептококки (ß-гемолитические), — вызывают лизис эритроцитов и образуют зону гемолиза вокруг колоний на кровяном агаре). Наибольшее значение в патологии человека имеет S. pyogenes.
— γ (гамма) -стрептококки (негемолитические) — не изменяют кровяной агар. Это сапротрофы, они широко распространены в окружающей среде, например, S. lactis, S. cremoris и др. В настоящее время в соответствии с Определителем Берджи они отнесены к роду Lactococcus.
Следует отметить, что классификация стрептококков по характеру гемолиза несовершенна, так как этот признак недостаточно постоянен и зависит от условий культивирования.
Альфа-стрептококки присутствуют в слюне и слизи из верхних дыхательных путей почти у 100% здоровых людей и обильно выделяются во внешнюю среду при разговоре, кашле, чихании, загрязняя воздух и другие объекты окружающей среды. Бета-стрептококки не относятся к облигатным обитателям дыхательных путей, выделяются только у 25-76% здоровых людей и всегда воспринимаются как потенциальная угроза для своего хозяина и его окружения. Исходя из этого, санитарно-показательными считают суммарно α- и ß-гемолитические стрептококки, они свидетельствуют о воздушно-капельном загрязнении окружающей среды. Негемолитические — стрептококки, не играющие роли в патологии человека, не включены в число санитарно-показательных.
Стрептококки менее устойчивы в окружающей среде, чем стафилококки. Наименее устойчивы α-гемолитические стрептококки, поэтому их считают показателем свежего загрязнения.
В целом, индикация и идентификация стрептококков более сложна и трудоемка по сравнению со стафилококками, что обуславливает преимущество последних как санитарно-показательных микроорганизмов.
ТЕРМОФИЛЬНЫЕ БАКТЕРИИ
К термофилам относят разнородную группу бактерий (грамположительные кокки, бациллы, спириллы, актиномицеты и др.), способных активно размножаться при высоких температурах. Они широко распространены в природе, обитают в термальных источниках, в верхних слоях почв пустынь, тропиков, окультуренных почвах средней полосы. Термофильные микроорганизмы размножаются в компостных кучах, навозе, разлагающихся фекалиях людей. В небольших количествах (101-103 кл/г испражнений, по E.H. Мишустину) термофилы обнаруживаются в выделениях из кишечника человека и теплокровных животных.
Учитывая столь широкое распространение термофилов, их нельзя рассматривать как показатель фекального загрязнения окружающей среды. Присутствие термофильных микроорганизмов свидетельствует о загрязнении окружающей среды разлагающимися органическими субстратами.
Загрязнение почвы и водоемов термофилами происходит при попадании в них навоза и компоста, содержащих разлагающиеся органические остатки. В незагрязненной почве, в целинных почвах термофилы не обнаруживаются или количество их ничтожно.
Количество термофилов в сочетании с другими показателями служит также для характеристики отдельных этапов процесса минерализации органических отходов, т.е. давности загрязнения (табл. 1). Так, сразу после попадания органических субстратов (навоз, компост) в объектах окружающей среды можно обнаружить большое количество БГКП (ОКБ), количество термофилов при этом невелико или умеренно, мало энтерококков и нитрификаторов, отсутствуют ТКБ. Давнее загрязнение характеризуется высокой численностью термофилов и нитрификаторов и незначительным количеством или полным отсутствием БГКП (ОКБ) и энтерококков.
Количество термофилов в сочетании с другими показателями служит также для характеристики отдельных этапов процесса минерализации органических отходов, т.е. давности загрязнения (табл. 1).
Так, сразу после попадания органических субстратов (навоз, компост) в объектах окружающей среды можно обнаружить большое количество БГКП (ОКБ), количество термофилов при этом невелико или умеренно, мало энтерококков и нитрификаторов, отсутствуют ТКБ.
Таблица 1
Соотношение различных групп санитарно-показательных микроорганизмов в зависимости от давности загрязнения
(с использованием данных Г.П. Калина, Г.Н. Чистович, 1969)
Примечание: очень много; много; мало: ± очень мало или отсутствуют.
Давнее загрязнение характеризуется высокой численностью термофилов и нитрификаторов и незначительным количеством или полным отсутствием БГКП (ОКБ) и энтерококков.
НИТРИФИЦИРУЮЩИЕ БАКТЕРИИ
Нитрифицирующие бактерии участвуют в минерализации азотсодержащих органических соединений в водоемах, в почве. Они окисляют аммиак, образующийся при разложении органических соединений аммонифицирующими микроорганизмами, до нитритов (первая стадия нитрификации) и нитратов (вторая стадия). Усиление нитрификационной деятельности происходит обычно во второй фазе самоочищения природных сред, когда накопившиеся к этому времени продукты распада (в основном аммиак) делают возможным усиленное размножение нитрификаторов. Поэтому наличие больших количеств нитрифицирующих бактерий в воде, почве указывает на относительно давнее загрязнение азотсодержащими органическими веществами и интенсивные процессы их распада.
В практике санитарно-микробиологических исследований обычно определяют титр нитрификаторов. В сочетании с другими показателями он дает представление о ходе отдельных этапов процесса самоочищения природных сред от азотсодержащих органических веществ (табл. 1).
2.4. Санитарно-показательные микроорганизмы различных объектов окружающей среды
В различных объектах внешней среды могут создаваться условия, при которых некоторые санитарно-показательные микроорганизмы либо быстро погибают, либо, напротив, получают возможность интенсивно размножаться. Поэтому определение лишь одной группы санитарно-показательных микроорганизмов может привести к серьезным ошибкам. Для того чтобы получить более полную санитарно-микробиологическую характеристику объекта, проводят комплексное определение загрязнения на основании поиска нескольких различных групп санитарно-показательных микроорганизмов (табл. 2).
Таблица 2
Санитарно-показательные микроорганизмы различных объектов окружающей среды
Выбор того или иного санитарно-показательного микроорганизма в пределах одной группы (например, определять БГКП, или ТКБ, или энтерококков, или тех и других представителей) диктуется задачами исследования. При этом в зависимости от поставленной задачи, можно определять:
— массивность того или иного загрязнения (количественный учет санитарно-показательных микроорганизмов);
— давность загрязнения (по количественному соотношению различных групп санитарно-показательных микроорганизмов, табл. 1);
— характер загрязнения (в зависимости от обнаруженных групп санитарно-показательных микроорганизмов).
Тема 3. Патогенные микроорганизмы в окружающей среде
3.1. Патогенность и вирулентность. Группы патогенных микроорганизмов
В зависимости от взаимоотношений с хозяином микроорганизмы делят на:
— непатогенные, т.е. практически безвредные;
— условно-патогенные, т.е. реализация их патогенности зависит от определенных условий. Их еще называют оппортунистами (англ. opportunity — удобный, подходящий случай, возможность). Почти все микробы-оппортунисты постоянно или временно входят в состав нормальной микробиоты человека и, следовательно, создают прецедент для различного рода инфекций (эндо- или аутогенных);
— патогенные, т.е. облигатно болезнетворные.
Патогенность — потенциальная способность микроба вызывать заболевание. Патогенные микроорганизмы характеризуются специфичностью: каждый вид способен вызывать только определенную болезнь с характерными для нее признаками (симптомами) и особенностью течения. Это обусловлено биологическими (генетическими) особенностями микроорганизмов.
Реализация микробом патогенных свойств, т.е. фенотипическое выражение генотипа, точно так же, как реализация любого другого генотипического признака, зависши от конкретных условий среды и определяется ими. Более подробно эти условия будут раскрыты при рассмотрении понятия «инфекция».
Степень патогенности может проявляться в фенотипе у разных штаммов[1] одного и того же вида микроорганизмов по-разному. Например, одни штаммы возбудителя туляремии вызывают гибель мышей в дозе 5-6 бактериальных клеток, другие — в дозах 105-10б клеток. Для характеристики степени патогенности применяют термин «вирулентность«: существуют высоковирулентные штаммы и штаммы со слабой (низкой) вирулентностью. Вирулентность измеряется условно принятой единицей, которая называется минимальная смертельная доза (DLM — dosis letalis minima).
DLM — наименьшее количество микробных клеток (или мкг токсина), которое при определенном способе заражения восприимчивого животного вызывает гибель 95-100% взятых в опыт лабораторных животных.
Для определения вирулентности используют также показатель LD50.
LD50 – количество микробных клеток (или мкг токсина), которое при определенном способе заражения восприимчивого животного вызывает гибель 50% лабораторных животных, взятых в опыт.
Вирулентность микробов может усиливаться или ослабевать как в естественных, так и в экспериментальных условиях. Снизить вирулентность можно, например, путем выращивания микроорганизмов при неблагоприятной температуре, на неблагоприятных ятя них субстратах, при добавлении в среду некоторых химических веществ, облучением УФ-лучами. Повысить вирулентность можно путем «пассажей» их через восприимчивый организм животного.
Следует отметить, что четкое смысловое разграничение между терминами «патогенность» и «вирулентность» отсутствует.
Свойства микроорганизмов, обусловливающие патогенное действие, довольно многообразны. Назовем важнейшие из них.
Способность к колонизации (заселению) зоны первичного инфицирования, т.е. входных ворот инфекции.
«Колонизация» означает закрепление (адгезию) и последующее размножение бактерий в зоне инфицирования. Некоторые бактерии активно готовят участки для закрепления, обнажая клеточные рецепторы, например при помощи фермента нейраминидазы. Другие сорбируются на бактериях, которые уже обосновались в данном биотопе. Существуют и другие механизмы колонизации.
Способность к инвазии, т.е. выходу за пределы зоны первичного инфицирования. При этом микроорганизмы проникают через кожные покровы и слизистые оболочки, попадают внутрь органов и тканей, размножаются в них, оказывая сопротивление защитным силам хозяина.
Разные бактерии неодинаково решают проблему прохождения через внешние покровы. Многие из них, особенно условно-патогенные, не способны к активному проникновению. Они пользуются пассивной инвазией, проникая через повреждения эпителия, посредством кровососущих насекомых и др. Другие имеют различные приспособления, облегчающие проникновение и распространение в организме хозяина, например:
— способность продуцировать ряд ферментов агрессии и защиты. К ним относятся, в частности, ферменты гиалуронидаза и фибринолизин, которые образуют патогенные стафилококки, стрептококки, клостридии и др. Гиалуронидаза расщепляет гиалуроновую кислоту, которая является одной из составных частей соединительной ткани и препятствует проникновению микроорганизмов в глубь органов и тканей. Фибринолизин растворяет сгустки фибрина, образующиеся в процессе воспаления и препятствующие продвижению микроорганизмов вглубь органов и тканей;
— способность образовывать капсулу, которая блокирует взаимодействие с фагоцитами.
Токсигенность (греч. toxicon — яд) — способность продуцировать токсические вещества — токсины, которые уже в малых дозах вызывают структурные или функциональные повреждения клеток. Токсины микроорганизмов обычно подразделяют на две группы: экзотоксины и эндотоксины. Основные их особенности указаны в таблице 3.
Названия токсинов традиционно базируется на категории поражаемых ими мишеней:
— энтеротоксины — поражают эпителий кишечника;
— нейротоксины — действуют на нервные клетки, межнейронные и нервно-мышечные синапсы;
— гемолизины лизируют эритроциты
— и др.
Инвазивность и токсигенность у различных патогенных микроорганизмов варьирует. Например, возбудитель чумы и туляремии обладает высокой инвазивностью, а возбудитель дифтерии и столбняка – высокой токсигенностью (образуют экзотоксины) и очень слабой инвазивностью.
Способность к персистенции (англ. persistent — стойкий, живучий). Это свойство обусловливает длительное сожительство бактерий с хозяином без каких-либо проявлений.
[1] Штамм – более узкое понятие, чем вид. Штаммом называют различные культуры одного вида, отличающиеся какими-либо, иногда очень незначительными, признаками от основного вида (местообитание, устойчивость к антибиотикам, вирулентность, отношение к температуре, и т.п.). Однако свойства отдельных штаммов не выходят за пределы вида.
Таблица 3
Характеристика микробных токсинов
(по Э. Джавец, 1982; Мудрецовой-Висс, 1978)
В соответствии с Санитарными правилами СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I-IV групп патогенности» (от 28.08.95 г. № 14) все патогенные микроорганизмы разделены на 4 группы в зависимости от степени опасности их для людей:
I группа. Возбудитель чумы.
II группа. Возбудитель холеры, сибирской язвы, туляремии, бруцеллеза, лептоспироза, сапа; возбудители грибковых заболеваний — гистоплазмоза; биологические яды — ботулиновый токсин типов А, В, Е, F.
III группа. Возбудители кишечных инфекций — брюшного тифа, дизентерии, возбудители туберкулеза, дифтерии; возбудители грибковых заболеваний — актиномикоза, дерматомикозов.
IV группа. Возбудители токсикоинфекций и острых бактериальных отравлений (сальмонеллы, стафилококки, клостридии и др.), энтеритов — эшерихии и др.
При санитарно-микробиологическом исследовании объектов окружающей среды чаще всего определяют микроорганизмы III–IV групп. Для работы с возбудителями I и II групп требуется специальное разрешение Главного государственного санитарного врача РФ и главных государственных санитарных врачей по субъектам РФ.
3.2. Инфекция: основные понятия и определения
Инфекция (от лат. infició — заражаю) — сложный биологический процесс, возникающий в макроорганизме в результате проникновения и развития в нем возбудителя болезни (инфекционного агента).
Источник возбудителя инфекции — это объект, являющийся местом естественной жизнедеятельности (т.е. обитания, размножения и накопления) возбудителя, из которого может происходить выделение возбудителя и заражение восприимчивого организма (хозяина).
Основные источники — человек и животные. В зависимости от источника возбудителя различают следующие виды инфекций:
Зоонозы (греч. zoon — животное и nosos — болезнь) — инфекционные болезни, при которых источником инфекции являются животные.
Зоонозы делят на:
— облигатные — единственным источником и хозяином возбудителя являются животные;
— необлигатные, или зооантропонозы, — инфекционные болезни животных, к возбудителям которых восприимчив человек. Источником является больное животное, заражение от человека, как правило, не наблюдается.
Антропонозы (греч. anthropos — человек и nosos — болезнь) — инфекционные болезни человека, возбудители которых в процессе эволюции приспособились к паразитированию только в организме человека. Источником инфекции является человек (больной или бактерионоситель).
Бактерионосительство — одна из форм инфекционного процесса, при которой присутствие возбудителей заразных болезней в организме человека и животного протекает без выраженных клинических проявлений болезни. По сути, оно представляет собой своеобразное биологическое равновесие, при котором организм хозяина не в силах вывести возбудителя, а возбудитель не в состоянии преодолеть защитные силы организма и вызвать болезнь. Следовательно, исход состояния носительства может быть двояким.
Носительство имеет большое эпидемическое значение, поскольку носитель не изолируется (кроме носителя холерного вибриона) и может длительное время выделять возбудителей в окружающую среду.
Сапронозы — заболевания, возбудители которых обитают и размножаются в объектах окружающей среды, откуда и попадают в организм человека.
Выделенные во внешнюю среду патогенные микроорганизмы попадают в почву, воду, воздух, на пищевые продукты, на различные предметы. Здесь они могут оставаться жизнеспособными более или менее длительное время.
Любая среда, в которой сохраняется возбудитель, и элементы внешней среды, обеспечивающие переход возбудителя из одного организма в другой, — это факторы, способствующие реализации механизма передачи возбудителя (вода, воздух, почва, пища, предметы обихода, а также живые переносчики — мухи, тараканы, клопы, вши и др.).
Механизм передачи возбудителя инфекции — это совокупность эволюционно сложившихся способов перемещения возбудителей инфекционных болезней от источника к хозяину.
Различают горизонтальные и вертикальные пути распространения инфекций. Под горизонтальной передачей понимают заражение между индивидуумами одного поколения, под вертикальной — от родителей детям. К горизонтальным механизмам передачи возбудителя инфекции относятся аспирационный, фекально-оральный, трансмиссивный, контактный, инструментальный.
Аспирационный (воздушно-капельный или воздушно-пылевой) осуществляется через верхние дыхательные пути.
Фекально-оральный (возбудитель поступает в окружающую среду с испражнениями, заражение происходит через рот). Реализуется несколькими путями:
— через воду — водный;
— пищу — алиментарный (от лат. alimentaris – пищевой);
— предметы обихода — бытовой;
Трансмиссивный (лат. transmissio — передача) осуществляется через укусы кровососущих членистоногих и реализуется двумя путями:
— инокуляционный — возбудитель вводится в организм человека через ротовой аппарат переносчика во время кровососания (клещевые энцефалиты, малярия и др.);
— контаминационный — переносчик загрязняет наружные покровы своими выделениями, содержащими возбудителя, после чего возбудитель втирается человеком в расчесы (вшивый сыпной тиф, вшивый возвратный тиф и др.).
Контактный (контагинозный) осуществляется через прямые контакты с больным (или бактерионосителем) или непрямые контакты (загрязненные предметы обихода и т.п.).
Инструментальный (артифициальный). В отличие от всех остальных, это искусственный путь заражения. Возбудители заболеваний передаются при использовании нестерильных медицинских приборов, особенно шприцев и т.п.
Вертикальный — от матери к плоду. Механизм передачи возбудителя осуществляется через плаценту, во время родов или сразу после них.
Для возникновения и развития инфекционного процесса недостаточно только проникновения возбудителя в организм хозяина. Возникновение инфекции и характер ее течения зависит от ряда условий:
1) количество и качество микроба — возбудителя (вирулентность), а в ряде случаев и место внедрения («входные ворота инфекции»);
2) степень восприимчивости хозяина. Восприимчивостью хозяина называют видовую особенность организма реагировать развитием инфекционного процесса в ответ на внедрение и жизнедеятельность в нем соответствующего возбудителя. Восприимчивость всегда носит потенциальный характер, и проявление ее может зависеть от:
— состояния микроорганизма (уже названная первая группа факторов);
— состояния макроорганизма. Для человека, например, восприимчивость определяется такими особенностями организма, как возраст, физиологическая активность, состояние нервной и эндокринной систем и др., а также социальными условиями (условиями труда и быта, характер питания);
3) факторы внешней среды, где происходит встреча возбудителя с хозяином: климатические (в жарком климате наблюдается повышенная заболеваемость кишечными инфекциями), физические (УФ-излучение, ионизирующая радиация), химические.
3.3. Краткая характеристика некоторых патогенных микроорганизмов
Окружающая среда и ее объекты, как уже было сказано, — это промежуточное звено, факторы, способствующие передаче возбудителей различных инфекционных заболеваний. Поэтому для контроля санитарного состояния окружающей человека среды с точки зрения эпидемической (без)опасности и своевременного проведения профилактических мероприятий важно не только установить источники инфекции, но и знать механизмы передачи и пути их реализации, а также сроки выживания патогенных микроорганизмов в объектах внешней среды. Именно этим вопросам, а также мерам профилактики, будет уделено основное внимание при характеристике возбудителей инфекционных заболеваний.
В данном курсе рассмотрим лишь некоторые патогенные микроорганизмы: те, которые представляют наибольшую опасность для человека, либо которые чаще всего вызывают те или иные заболевания и с которыми студенты могут столкнуться в повседневной жизни и при прохождении полевой практики.
ЭШЕРИХИИ
Род Echerichiaс типовым видом Е. coli относится, как уже было сказано выше, к сем. Enterobacteriaceae группы 5 «Факультативно анаэробные грамотрицательные палочки». Е. coli — кишечная палочка — типичный обитатель кишечника человека и теплокровных животных. Впервые была выделена из испражнений человека в 1885 году немецким бактериологом Т. Эшерихом.
Кишечная палочка, являясь условно-патогенным микроорганизмом, при попадании из своего биотопа (кишечника) в несвойственные ей биотопы (другие органы и ткани) может вызывать парентеральные[1] формы эшерихиозов, протекающие как менингит, энцефалит, пиелонефрит, цистит, холецистит, аппендицит, пневмония, панкреатит, отит, конъюнктивит и другие воспалительные процессы вплоть до сепсиса. Такие инфекции обычно возникают эндогенно, за счет штаммов, колонизующих кишечник.
Самостоятельную группу заболеваний составляют эшерихиозы, возбудителями которых являются диареегенные[2] штаммы Е. coli, считающиеся патогенными разновидностями кишечной палочки. Эти заболевания возникают экзогенно и протекают с преимущественным поражением кишечника — энтеральные эшерихиозы. Диареегенные эшерихии могут образовывать эндотоксин, который обладает энтеротропным и пирогенным свойствами, а также выделять экзотоксин, обладающий нейротоксическими свойствами. Некоторые штаммы способны продуцировать гемолизин и экзотоксин с энтеротропным действием.
Источником энтеральных эшерихиозов являются больные люди и бактерионосители.
Механизм передачи — фекально-оральный; пути передачи — пищевой (основной), водный, бытовой (через загрязненные руки, игрушки и др.). Естественная восприимчивость людей высокая, особенно выраженная среди новорожденных и ослабленных детей. Около 35% детей, общавшихся с источником возбудителя инфекции, становятся носителями.
Резистентность возбудителя. Диареегенные эшерихии устойчивы в окружающей среде, сохраняя жизнеспособность в молоке до 34 дней, детских питательных смесях — до 92 дней, на игрушках и предметах обихода до 3-5 месяцев. При 60°С гибнут через 10 мин, при кипячении — мгновенно, под действием 1%-ного раствора хлорамина, 1-2%-ного раствора хлорной извести, 1%-ного раствора фенола, 3%-ного раствора лизола — за 15-30 минут.
Профилактика.Профилактические мероприятия должны быть особенно строгими в лечебных детских учреждениях, где находятся дети первого года жизни (особенно первого полугодия). Мероприятия направлены на предупреждение заноса инфекции в эти учреждения. раннее выявление и изоляцию больных. С этой целью обследуют на эшерихиозы беременных перед родами, а также рожениц и новорожденных, у которых можно заподозрить эшерихиозную инфекцию. При выявлении изолируют заболевших, обследуют персонал на носительство патогенных эшерихий. При эшерихиозах взрослых профилактику проводят так же, как при дизентерии.
САЛЬМОНЕЛЛЫ
К роду Salmonella сем. Enterobacteriасеае относятся возбудители брюшного тифа, паратифов А и В, сальмонелле зов (или пищевых токсикоинфекций).
Сальмонеллы содержат эндотоксин, который играет большую роль в патогенезе заболеваний, способствуя быстрому проникновению возбудителей из кишечника в лимфатическую систему и кровь и вызывая интоксикацию организма. Все заболевания, вызываемые сальмонеллами, характеризуются поражением желудочно-кишечного тракта и общей интоксикацией.
Брюшной тиф и паратифы А и В — острые инфекционные заболевания, возбудителями которых являются соответственно S. typhi и S. paratyphi А и В. Впервые были обнаружены в 1880 году Эбертом у людей, умерших от брюшного тифа, в 1884 году выделены Гаффки в чистую культуру.
Источникраспространения инфекции — больной человек и бактерионоситель, а при паратифе В им могут быть и животные (крупный рогатый скот и др.). После перенесенного заболевания часть переболевших людей остаются длительное время бактерионосителями (иногда на многие месяцы и даже годы). Восприимчивость высокая и не зависит от возраста и пола.
Механизм передачи — фекально-оральный; пути передачи — пищевой (особенно часто – инфицированные молоко, холодные мясные блюда и др.), водный, контактно-бытовой (через загрязненные руки, посредством механических переносчиков — мух и др.).
Наиболее часто встречаются сальмонеллезы, протекающие по типу пищевых токсикоинфекций. Это острые кишечные заболевания, возбудителями которых чаще всего являются S. typhimurium и S. enteritidis. Впервые выделены в 1885 году Сальмоном от больных свиней.
Источником сальмонелл — возбудителей пищевых токсикоинфекций — являются больные животные или бактерионосители (коровы, овцы, лошади, свиньи, кошки, собаки и др.). Основную роль в возникновении заболеваний играет крупный рогатый скот, свиньи, домашняя птица. Человек — больной или бактерионоситель – может также быть источником возбудителей, но его роль в возникновении пищевых токсикоинфекций незначительна.
Механизм передачи — фекально-оральный; пути передачи — пищевой, водный, контактно-бытовой (через загрязненные руки и др.). Сальмонеллы — возбудители пищевых токсикоинфекций — попадают в окружающую среду с хозяйственно-фекальными сточными, талыми, ливневыми водами, содержащими выделения кишечника человека и животных. Наибольшее значение в загрязнении сальмонеллами вод открытых водоемов имеют сточные воды боен, птицефабрик, скотных дворов, имеющие высокую обсемененность сальмонеллами. Загрязнение водоемов приводит к тому, что животные заражаются во время водопоя, а затем заболевают или остаются бактерионосителями.
Главную опасность в возникновении заболевания представляет мясо вынужденно забитых больных животных, особенно когда оно реализуется без санитарного контроля. Инфицирование мяса и мясных продуктов сальмонеллами — возбудителями пищевых токсикоинфекций — может происходить различными путями:
- при жизни животных, когда вследствие бактериемии[3] микробы попадают в мышечную ткань;
- после убоя, проводимого в антисанитарных условиях, при разделывании туш — вследствие попадания на мышечную ткань содержимого кишечника или при соприкосновении здоровой туши с зараженной, например, при использовании одних и тех же инструментов;
- при неправильном хранении, транспортировке в результате заражения грызунами, которые выделяют сальмонелл с фекалиями и мочой;
- в процессе приготовления пищи при нарушении технологии или недостаточной термической обработке;
- при неправильном и длительном хранении приготовленных
блюд.
Резистентность возбудителя. Сальмонеллы вне организма обладают высокой степенью устойчивости к воздействию различных факторов окружающей среды. Они хорошо переносят низкую температуру, выдерживают замораживание в течение нескольких месяцев. В холодной стоячей воде сохраняются до 2 лет, в водопроводной — до 3 месяцев, в почве — от 1 до 9 месяцев. Однако они быстро погибают под действием высокой температуры: при 70°С — через 5-10 мин, при кипячении — мгновенно. Губительно действуют на сальмонелл прямые солнечные лучи, дезинфицирующие средства. Сальмонеллы могут длительно сохраняться в различных пищевых продуктах: мясе, мясном фарше, студне, молоке, кондитерских изделиях и при благоприятных условиях размножаться в них. Следует помнить, что органолептические свойства продуктов, в которых произошло размножение сальмонелл, не изменяются.
Профилактика. Санитарный надзор за пищевыми предприятиями, водоснабжением, канализацией. Раннее выявление больных и их изоляция. Дезинфекция помещения, белья, посуды, которые кипятят после употребления, борьба с мухами. Диспансерное наблюдение за переболевшими.
[1] Парентеральный (греч. entera — кишка) — минуя кишечник.
[2] Диареегенность – способность поражать эпителий кишечника.
[3] Бактериемия — наличие живых бактерии в крови.
ШИГЕЛЛЫ
Бактерии рода шигелл вызывают дизентерию — острое инфекционное заболевание с поражением толстой кишки (воспаление, поверхностные эрозии и язвы) и общей интоксикацией.
Возбудитель относится к роду Shigella сем. Enterobacteriaceae (гр. 5 «Факультативно анаэробные грамотрицательные палочки» по Берджи). Род получил название в 1950 году в честь японского исследователя К. Шига, описавшего в 1898 году одного из возбудителей дизентерии.
Шигеллы содержат эндотоксин, обладающий свойствами энтеротоксина, S. dysenteriae, помимо эндотоксина, продуцирует экзотоксин, оказывающий энтеротропное, цитотоксическое и нейротоксическое действие, особенно на вегетативную нервную систему. Они вызывают наиболее тяжелую форму дизентерии.
Источник инфекции — больной человек и бактерионоситель.
Механизм передачи — фекально-оральный, реализуется водным, алиментарным и бытовым путем при загрязнении воды, пищевых продуктов, предметов непосредственно руками или механическими переносчиками — мухами.
Резистентность возбудителя. Резистентность шигелл в окружающей среде невелика и неодинакова. Наименее устойчивы S. dysenteriae, самые устойчивые S. sonnei. Шигеллы очень чувствительны к высоким температурам: нагревание в жидкой среде до 60° С вызывает их гибель через 10 мин, кипячение — мгновенно. В лучах прямого солнечного света они погибают в течение 30 мин. Чувствительны к дезинфицирующим веществам: 1%-ный раствор фенола убивает возбудителей за 30 минут.
Выживаемость в окружающей среде в значительной степени зависит от конкретных условий среды и конкуренции сопутствующей микрофлоры. Например, на поверхности почвы в летнее время шигеллы сохраняются 2-3 дня, в более глубоких слоях — 10-20 дней. В зимнее время жизнеспособность шигелл в почве более продолжительна. Сроки выживания в воде находятся в прямой зависимости от характера воды (речная, колодезная, водопроводная и т.д.) и температуры. Так, в речной воде летом шигеллы могут сохраняться до 35 суток, в водопроводной (при содержании активного хлора 0,2-0,5 мл/л) выживают около 2 ч (при искусственном заражении воды).
Шигеллы всех видов хорошо размножаются во многих пищевых продуктах, особенно сыром молоке, сметане, твороге, сливочном масле, в продуктах, прошедших термическую обработку (салаты, кисели и т.д.). Чаще других видов массовые заболевания, протекающие по типу пищевых токсикоинфекций, вызывают S.sonnei.
Профилактика. Раннее выявление и лечение больных, санитарный контроль за источниками водоснабжения, пищевыми предприятиями, меры по борьбе с мухами, индивидуальная гигиена.
ХОЛЕРНЫЕ ВИБРИОНЫ
Холерные вибрионы являются возбудителями холеры — острого инфекционного заболевания, характеризующегося общей интоксикацией, поражением тонкого кишечника, нарушением водно-солевого обмена и обезвоживанием организма.
Возбудитель холеры относится к роду Vibrio сем. Vibrionaceae (гр. 5 «Факультативно анаэробные грамотрицательные палочки» по Берджи), виду V. cholerae. Он включает как патогенные, способные вызывать заболевания, склонные к эпидемическому и пандемическому распространению, так и свободноживущие в воде вибрионы, безопасные для человека или обусловливающие спорадические случаи диарей и инфекций с вне кишечной локализацией возбудителя.
К настоящему времени известны три варианта возбудителя холеры:
— два классических: холерные вибрионы V. cholerae O1 (cholerae), открытые в 1883 году Р. Кохом, и эльтор — V. cholerae О1 (eltor), открытый в 1906 году Ф. Готшлихом (варианты Огава, Инаба, Гикошима);
— холерные вибрионы новой О139 серогруппы.
Патогенность холерных вибрионов обусловлена способностью к колонизации и продукции ряда токсинов, в первую очередь экзоэнтеротоксина — холерогена.
Источникинфекции — больной человек и вибриононоситель.
Механизм передачи — фекально-оральный, один из главных путей реализации — водный. Некоторые биотипы длительно сохраняются и размножаются в воде, в иле, в организмах обитателей водоемов. Кроме водных, бывают пищевые, контактно-бытовые и смешанные эпидемии холеры. Восприимчивость к холере высокая.
Резистентность возбудителя. Холерные вибрионы характеризуются относительно невысокой резистентностью. При температуре 56°С они гибнут через 25-30 мин, при кипячении — через 1 минуту. Очень чувствительны к действию 3%-ного раствора карболовой кислоты — выживают не более 3-5 мин. Быстро погибают в лучах прямого солнечного света. При низких температурах они могут сохраняться в испражнениях, почве, воде от нескольких недель до 2-3 месяцев, могут «перезимовывать» во льду. На различных пищевых продуктах со щелочной и нейтральной реакцией при температуре 20 -25°С и рассеянном свете могут оставаться жизнеспособными в течение 2-3 суток. Вибрионы Эль-Тор характеризуются большей резистентностью в окружающей среде.
Профилактика. Холера относится к числу особо опасных карантинных инфекций. Состояние заболеваемости холерой в мире в настоящее время определяется эпидемиями и вспышками инфекции в Африке, Индии, Индонезии, где сформировались эндемичные очаги холеры. Для Российской Федерации, где обстановка по холере оценивается как неустойчивая, проблема холеры также продолжает сохранять свою актуальность из-за постоянной угрозы возможных завозов инфекции всеми видами транспорта на любую административную территорию.
Организация и проведение противохолерных мероприятий в РФ строится в соответствии с приказом Министерства здравоохранения РФ от 05.02.2004 г. № 37 «О взаимодействии по вопросам обеспечения санитарной охраны территории Российской Федерации и проведения мероприятий по профилактике карантинных и других особо опасных инфекций», а также согласно Санитарным правилам СП 3.1.1086-02 «Профилактика холеры. Общие требования к эпидемиологическому надзору за холерой».
При этом особое внимание уделяется:
— проведению санитарно-карантинного контроля в пунктах пропуска через границу за пассажирами, прибывающими из стран, неблагополучных по холере;
— надзору за санитарно-гигиеническим состоянием территорий населенных пунктов, особенно местам неорганизованного рекреационного водопользования;
— контролю за сбросом сточных вод в открытые водоемы;
— охране и обеззараживанию питьевой воды;
— готовности учреждений здравоохранения и Госсанэпиднадзора к выявлению на всех этапах и оказанию медицинской помощи больным (подозрительным) холерой;
— организации и проведению широкой информационно-разъяснительной работы с населением по вопросам профилактики холеры.
ЛЕПТОСПИРЫ
Лептоспиры вызывают лептоспирозы — острые инфекционные заболевания, характеризующиеся поражением печени, почек, нервной системы и протекающие в виде желтушной или безжелтушной формы.
Возбудитель относится к спирохетам рода Leptospira (гр. 1 «Спирохеты» по Берджи), наиболее распространен вид L. interrogans.
Основным резервуаром лептоспир в природе служат различные виды мелких влаголюбивых мышевидных грызунов — полевки, полевые мыши, серая крыса. Природные очаги лептоспирозов приурочены главным образом к сырым, заболоченным и чрезмерно увлажненным местам.
Источником лептоспирозов являются сельскохозяйственные животные (крупный и мелкий рогатый скот, свиньи, лошади), промысловые звери (лисицы, песцы), домашние и одомашненные животные (собаки, кошки, олени), которые восприимчивы к лептоспирам. Во внешнюю среду лептоспиры выделяются с мочой животных. Роль больного человека как источника инфекции незначительна.
Механизм передачи — оральный, основной путь заражения — водный, кроме того пищевой и контактно-бытовой. Заражение людей происходит при купании или питье воды из загрязненных лептоспирами водоемов, при сенокошении на заболоченных лугах, при уходе за животными, больными лептоспирозом или являющимися носителями лептоспир.
Резистентность возбудителя. Лептоспиры чувствительны к нагреванию (погибают при температуре 50-55°С в течение 3 ч), высушиванию, УФ-облучению, кислотам, щелочам, дезинфицирующим веществам; устойчивы к действию низких температур. В водоемах сохраняются до 3 недель, в почве — до 3 месяцев, в пищевых продуктах — несколько дней.
Особенность распространения лептоспирозов в последние годы — повышенная заболеваемость горожан по сравнению с сельскими жителями. Осложнению ситуации способствует увеличение бездомных животных, связанное с ухудшением социальных, экономических, бытовых условий жизни населения города, а также свободная, бесконтрольная торговля в городах мясом и другими продуктами питания.
Профилактика. Основными профилактическими мерами являются санитарный контроль в местах рекреационного водопользования, за источниками питьевого водоснабжения, в местах торговли мясом и другими продуктами питания (рынки), а также выявление и лечение больных сельскохозяйственных и домашних животных.
ВОЗБУДИТЕЛЬ ТУЛЯРЕМИИ
Возбудитель туляремии – Francisella tularensis — вызывает острое инфекционное заболевание септического характера с поражением лимфатических узлов и различных органов — глаз, легких, желудочно-кишечного тракта и др. Учитывая некоторые черты сходства клинической картины с чумой, ее даже называли «малая чума».
F. tularensis относится в соответствии с Определителем Берджи к гр. 4 «Грамотрицательные аэробные/микроаэрофильные палочки и кокки». Выделена в 1912 году Г. Мак-Коем и Ш. Чепином в районе оз. Туляре штата Калифорния и изучена Э. Франсисом.
Патогенное действие обусловлено токсическими продуктами типа эндотоксинов. Обладает высокой инвазионной способностью и может легко преодолевать даже неповрежденные кожные покровы и слизистые оболочки.
Туляремия — природно-очаговая инфекция. Природным резервуаром и источником являются около 125 видов позвоночных животных, преимущественно представители отряда грызунов: водяные крысы, полевки, домовые мыши, зайцы и др. В природных очагах периодически возникают эпизоотии, на фоне которых наблюдаются заболевания людей, принимающие при наличии соответствующих предпосылок характер эпидемических вспышек. Сохранение возбудителя туляремии в природе и передача его осуществляется при участи кровососущих эктопаразитов (клещи и др.). Природные очаги этой инфекции характеризуются исключительной стойкостью, что связано с постоянным обменом бактериями туляремии между клещами и животными.
Для туляремии характерны многообразные механизмы передачи возбудителя, что является важным признаком особо опасных инфекций:
— трансмиссивный — осуществляется посредством клещей и летающих кровососущих двукрылых (комары и слепни):
— контактный — при контакте с зараженными грызунами при разделке туш, снятии шкурок и т.п.;
— аспирационный — при обмолоте хлеба, обработке зерновых продуктов;
— оральный — через инфицированные пищевые продукты и воду.
Больной человек не является источником распространения болезни.
Резистентность возбудителя. Возбудитель сравнительно устойчив к воздействию внешних факторов среды: в зерне и соломе при температуре ниже 0°С сохраняется до 6 мес, в воде при 4°С — более 4 мес, во льду — до 6 мес, в почве — от 10 дней до 2,5 мес в зависимости от влажности и температуры, в замороженном мясе и молоке — до 3 месяцев. Микробы нестойки к высоким температурам: при кипячении гибнут моментально, при нагревании до 60°С — через 5-10 минут. В высушенных шкурках животных возбудитель остается жизнеспособным до 40 дней. Чувствителен к действию прямых солнечных лучей и действию дезинфицирующих веществ.
Распределение заболеваемости туляремией в России имеет региональный характер, а также отличается у сельских и городских жителей. В последние годы наметилась тенденция по увеличению заболеваемости туляремией среди горожан. Объяснить эту закономерность можно ослаблением внимания к вакцинации угрожаемых контингентов, недостаточной санитарно-просветительной работой местных эпидемиологических служб в сочетании с массовым освоением городскими жителями пригородных территорий — дачное строительство, работы на садовых и огородных участках, промысловая деятельность.
Профилактика. Ликвидация природных очагов или сокращение их территорий. Защита жилищ, колодцев, открытых водоемов, продуктов от мышевидных грызунов. Проведение массовой плановой вакцинации в очагах туляремии.
Специальная часть
Тема 4. Санитарная микробиология воды
4.1. Краткая характеристика микроорганизмов водоемов. Биологическая контаминация и самоочищение вод
Вода является естественной средой обитания разнообразных микроорганизмов. В водоемах присутствуют представители почти всех систематических и физиологических групп бактерий, которые встречаются в почве, воздухе, на растениях и животных. Имеющиеся отличия в качественном и количественном составе микроорганизмов различных природных вод зависят от происхождения вод, целей их использования, а также от степени изученности.
По происхождению воды делят на:
— поверхностные (проточные — реки, ручьи, каналы; стоячие — озера, пруды, водохранилища, болота);
— подземные (почвенные, грунтовые, артезианские);
— атмосферные (дождь, снег);
— морские.
В зависимости от целей использования вод различают следующие виды водопользования (ГОСТ 17.1.1.03-86 «Охрана природы. Гидросфера. Классификация водопользований»):
— хозяйственно-питьевые и коммунально-бытовые нужды населения;
— лечебные, курортные и оздоровительные цели;
— нужды сельскохозяйственного производства;
— промышленные нужды;
— нужды водного транспорта и лесосплава, рыбного хозяйства;
— сброс сточных вод и прочие нужды.
Поверхностные воды, широко используемые человеком, являются наиболее загрязненными и могут содержать, в зависимости от степени загрязнения, миллиарды клеток бактерий в 1 мл.
Грунтовые воды залегают над первым водонепроницаемым пластом почв (глина, гранит, известняки). В них могут присутствовать возбудители различных инфекций, так как эти воды ненадежно защищены от поверхностных загрязнений.
Над грунтовыми водами под землей собирается верховодка. Так как она залегает наиболее близко к поверхности земли, то легко загрязняется отходами жизнедеятельности людей и выделениями животных и поэтому считается наименее пригодной из всех подземных вод.
Артезианские воды залегают ниже одного либо нескольких водоупорных слоев, находятся под давлением (напором), бедны микроорганизмами и не содержат в обычных условиях болезнетворных бактерий, что связано с малым количеством питательных веществ в них и фильтрующим эффектом почвы.
Соленые водоемы отличает наличие галофильных и галотолерантных форм. Специфической группой являются термофильные микроорганизмы, рост и развитие которых происходит при повышенных температурах, и психрофильные микроорганизмы, способные расти при температуре 0°С и ниже.
С экологической точки зрения все водные микроорганизмы можно разделить на две группы:
— аллохтонные — поступающие извне микроорганизмы (биологическое загрязнение, контаминация);
— автохтонные — постоянно живущие в данном водоеме, т. е. собственно водные микроорганизмы, приспособленные к экологическим условиям данного водоема.
Аллохтонные микроорганизмы составляют лишь небольшую часть микробного населения водоемов. При оценке санитарного состояния водоемов именно эта группа представляет интерес с точки зрения установления эпидемической (без)опасности водных объектов. Изучение данной группы предполагает:
— выяснение источников ее происхождения;
— определение времени ее жизнеспособности.
Основным источником аллохтонных микроорганизмов в открытых водоемах являются сточные воды. Согласно МУ 2.1.5.800-99 «Организация Госсанэпиднадзора за обеззараживанием сточных вод» к наиболее опасным в эпидемиологическом отношении относят следующие виды сточных вод:
— хозяйственно-бытовые сточные воды;
— городские сточные воды;
— сточные воды инфекционных больниц;
— сточные воды от животноводческих и птицеводческих объектов и предприятий по переработке продуктов животноводства, стоки шерстомоек, биофабрик, мясокомбинатов и т.д.;
— поверхностно-ливневые стоки;
— дренажные воды.
Кроме того, вода открытых водоемов может загрязняться при водопое скота, в результате использования водоема в хозяйственно-бытовых, транспортных (флот), рекреационных и других целях.
Аллохтонная группа может быть представлена сапротрофными, условно-патогенными и патогенными микроорганизмами. Наиболее опасным в эпидемическом отношении является присутствие в водоемах двух последних групп. Среди патогенных микроорганизмов чаще других в водоемах обнаруживаются сальмонеллы (p. Salmonella), шигеллы (p. Shigella), лептоспиры (p. Leptospira), энтеропатогенные Escherichia coli, холерные вибрионы (p. Vibrio cholerae), энтеровирусы человека и др. Сроки их выживания зависят от многих факторов, о которых будет сказано ниже.
Процесс освобождения водоемов от различного рода загрязнений естественным путем называется самоочищением. Этот процесс представляет большой интерес с санитарной точки зрения.
Самоочищение является суммой процессов, которые приводят загрязненную воду по содержанию органических веществ и наличию микроорганизмов к исходному состоянию. Самоочищение открытых водоемов протекает под влиянием разнообразных факторов. Назовем их:
— гидравлические — разбавление и смешение попавших загрязнений с основной массой воды;
— механические — осаждение на дно взвешенных частиц и микроорганизмов;
— физические — влияние солнечной радиации, температуры (зимой процессы самоочищения замедляются, патогенные микроорганизмы дольше сохраняются);
— химические — превращение одних веществ в другие, главным образом минерализация; угнетение или стимуляция тех или иных групп микроорганизмов и других гидробионтов различными химическими веществами;
— биологические — сложные процессы взаимодействия автохтонных водных микро- и макроорганизмов с аллохтонными микроорганизмами. Самоочищение воды от привнесенных бактерий (в том числе патогенных) происходит за счет их гибели в результате антагонистического воздействия водных организмов (конкуренция за питательные вещества, действие антибиотических веществ, бактериофагов, поедание простейшими, паразитизм и другие факторы).
Наиболее интенсивно естественное самоочищение происходит в проточных водоемах.
Как показывают статистические данные, с начала 70-х годов XX столетия во всех странах мира стало расти число вспышек кишечных инфекций, распространение которых происходит посредством водного фактора передачи. При этом эпидемическое неблагополучие в большей мере связано с недостатками в системе контроля за качеством воды и в меньшей мере с несовершенными методами обеззараживания. Поэтому требуется постоянный контроль за качеством используемой населением воды с тем, чтобы своевременно можно было бы осуществить необходимые профилактические мероприятия.
4.2. Санитарно-микробиологический контроль качества вод
В соответствии с Законом РФ «О санитарно-эпидемиологическом благополучии населения» водные объекты, используемые в тех или иных целях, не должны являться источниками биологических, химических и физических факторов вредного воздействия на здоровье человека.
Основные понятия в области качества вод установлены ГОСТ 27065-86 (СТ СЭВ 5184-85) «Качество вод».
Качество воды— характеристика состава и свойств воды, определяющая пригодность ее для конкретных видов водопользования[1].
Необходимо отметить, что в последние десятилетия усилилась тенденция к оценке состояния водных объектов не только с точки зрения потребностей конкретного природопользователя, но и с точки зрения структуры и функциональных особенностей водной экосистемы в целом. При этом степень экологического неблагополучия водоемов оценивают по двум основным факторам:
- опасное для здоровья людей снижение качества питьевой воды и воды водных объектов рекреационного назначения, т. е. фактор изменения среды обитания человека (санитарно-гигиенический аспект);
- создание угрозы деградации или нарушения функций воспроизводства основных биотических компонентов естественных экологических систем водоемов, т.е. «общеэкологический» фактор изменения природной среды (экологический аспект).
Экологический аспект достаточно подробно рассмотрен в учебном пособии по санитарной гидробиологии В.П. Семерного (2001). В курсе «Санитарный микробиологии» нас будет интересовать качество вод с точки зрения пригодности их использования для конкретных видов деятельности человека, т. е. санитарно-гигиенический аспект.
Человек для своих многочисленных нужд использует как поверхностные, так и подземные воды. Гигиенические требования к качеству и охране поверхностных вод изложены в СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод». Он устанавливает нормативы и требования:
— к качеству воды водных объектов в пунктах питьевого, хозяйственно-бытового и рекреационного водопользования;
— к условиям отведения сточных вод в водные объекты;
— к размещению, проектированию, строительству, реконструкции и эксплуатации хозяйственных и других объектов, способных оказать влияние на состояние поверхностных вод;
— к организации контроля за качеством воды водных объектов.
Назначение норм состоит в предупреждении возможности токсического действия загрязнителей на организм человека, изменения органолептических свойств воды, распространения инфекционных заболеваний, угнетения водных организмов, которые обеспечивают процессы биологического самоочищения водоемов. Отдельные нормативы дифференцированы для двух категорий водопользования.
К первой категории водопользованияотносится использование водных объектов или их участков в качестве источника питьевого и хозяйственно-бытового водоснабжения, а также для водоснабжения предприятий пищевой промышленности.
Ко второй категории водопользования относится использование водных объектов или их участков в рекреационных целях.
Нормирование качества вод проводят по следующим показателям:
— органолептическим (температура, запах, привкус, цветность, мутность);
— химическим (показатели химического состава);
— санитарным (ПАВ, БПК, ХПК, перманганатная окисляемость, аммоний, нитриты, нитраты);
— биологическим (микробиологическим, паразитологическим).
Мы более подробно остановимся на микробиологических показателях. Согласно МУ по санитарно-биологическому анализу воды поверхностных водоемов № 2285-81 они включают основные и дополнительные показатели.
Основные:
1) определение числа мезофильных сапротрофных аэробных и
факультативно анаэробных микроорганизмов, вырастающих при температуре 20-22 °С и 37°С. Соотношение численности этих групп микроорганизмов позволяет судить о динамике и интенсивности процесса самоочищения. При 20-22°С вырастает больше сапротрофных микроорганизмов, чем при 37°С. Эта разница более выражена при завершении процесса самоочищения. В местах загрязнения хозяйственно-бытовыми сточными водами численные значения обеих групп близки. Сапротрофы, вырастающие при 20-22°С, являются активными участниками процесса самоочищения водоемов. Динамика численности сапротрофов, вырастающих при 37°С, является чувствительным индикатором загрязнения вод, в частности органическими веществами;
2) определенные ЛКП (или ОКБ).
Дополнительные:
3) определение числа бляшкообразующих единиц (БОЕ) фагов кишечных палочек. Определение числа БОЕ фагов кишечных палочек в воде осуществляется в том случае, если невозможно или затруднено проведение исследований на содержание кишечных вирусов;
4) определение бактерий родов Salmonellaи Shigella. Это исследование проводят при неблагоприятной санитарной и эпидемической обстановке, а также при превышении нормативов по коли-индексу. Выделение из воды сальмонелл тифа, паратифов и шигелл свидетельствуют об эпидемической опасности данного водного объекта. В этом случае он не может служить источником водоснабжения и для рекреационных целей;
5) определение числа Esherichia coli, (или ТКБ). Этот показатель определяют при оценке качества воды поверхностных водоемов для расшифровки характера и происхождения микробного загрязнения, превышающего норматив. Наличие в воде Е. coli свыше 1000 кл/л свидетельствует о недавнем поступлении хозяйственного-фекального загрязнения, о незавершенных процессах самоочищения, о несоблюдении требований к очистке сточных вод. В этих случаях водоем представляет потенциальную эпидемическую опасность;
6) определение числа энтерококков. Энтерококки рекомендуется определять для подтверждения фекального характера загрязнения. При индексе энтерококков свыше 500 предполагается поступление свежего фекального загрязнения и опасность в эпидемическом отношении;
7) определение числа стафилококков. Стафилококки определяют в воде водоемов, используемых для купания. Сигнальное значение для регламентации нагрузки на зону купания имеет наличие свыше 100 стафилококков в 1 л воды;
8) определение холерного вибриона.
Требования к микробиологическим показателям качества воды водных объектов в контрольных створах и в местах питьевого, хозяйственно-бытового и рекреационного водопользования приведены в таблице 4.
В целях охраны водных объектов от загрязнения не допускается сбрасывать в водных объекты сточные воды, которые содержат возбудителей инфекционных заболеваний бактериальной, вирусной и паразитарной природы. Сточные воды, опасные по эпидемиологическому критерию, могут сбрасываться в водных объекты только после соответствующей очистки и обеззараживания до числа термотолерантных колиформных бактерий 100 КОЕ/100мл, числа общих колиформных бактерий 500 КОЕ/100 мл и числа колифагов 100 БОЕ/100 мл.
Место выпуска сточных вод населенного пункта должно быть расположено ниже по течению, за его пределами, с учетом возможного обратного течения при нагонных явлениях.
[1] Водопользование – юридически обусловленная деятельность граждан, юридических лиц, связанная с использованием водных объектов.
Таблица 4
Микробиологические показатели качества воды водных объектов в контрольных створах и в местах питьевого, хозяйственно-бытового и рекреационного водопользования
(по СанПиН 2.1.5.980-00)
* Для централизованного водоснабжения; при нецентрализованном питьевом водоснабжении вода подлежит обеззараживанию.
Для объектов, сбрасывающих сточные воды, устанавливаются нормативы предельно допустимых выбросов веществ в водные объекты (ПДС). ПДС устанавливаются для каждого выпуска сточных вод и для каждого загрязняющего вещества, в том числе продуктов трансформации, исходя из условия, что их концентрации не будут превышать гигиенические нормативы химических веществ и микроорганизмов в воде водного объекта в створе не далее 500 м от места выпуска.
Выпуск сточных вод предприятий должен осуществляться согласно МУ 2.1.5.800-99 «Организация Госсанэпиднадзора за обеззараживанием сточных вод», а также при соблюдении требований МУ 2.1.5.732-99 «Санитарно-эпидемиологический надзор за обеззараживанием сточных вод ультрафиолетовым излучением».
Системы питьевого водоснабжения относятся к особо важным объектам жизнеобеспечения человека, поэтому их функционирование должно обеспечиваться в приоритетном порядке. Обеспечение безопасности и надежности систем питьевого водоснабжения достигается за счет:
— выбора источников питьевого водоснабжения и соответствующих технологий подготовки питьевой воды на основе гигиенических нормативов;
— охраны источников и систем питьевого водоснабжения;
— приоритета использования в целях питьевого водоснабжения подземных вод.
В зависимости от забора воды различают несколько видов водоснабжения:
- централизованное питьевое и хозяйственно-бытовое водоснабжение — комплекс инженерных сооружений для забора, подготовки, транспортирования и подачи потребителю питьевой воды;
- нецентрализованное (местное) питьевое и хозяйственно-бытовое водоснабжение — использование подземных или поверхностных водоисточников для питьевых и бытовых нужд при помощи водозаборных устройств без разводящей водопроводной сети.
Выбор источника централизованного питьевого водоснабжения проводится согласно ГОСТ 2761-84 «Источники централизованного хозяйственно-питьевого водоснабжения». Он устанавливает гигиенические и технические требования к источникам водоснабжения и правила их выбора в интересах здоровья населения.
Источники водоснабжения и водопроводные сооружения, а также территории, на которых они расположены, должны быть защищены от загрязнения путем организации зоны санитарной охраны (ЗСО). На территории ЗСО устанавливается специальный режим и определяется комплекс мероприятий согласно СанПиН 2.1.4.1110-02, направленных на предупреждение ухудшения качества воды.
В частности, не допускается сброс любых сточных вод в пределах первого пояса СЗО источников хозяйственно-питьевого водоснабжения. В пределах второго пояса ЗСО сброс сточных вод не допускается, если содержание в них загрязняющих веществ и микроорганизмов превышает установленные СанПиН 2.1.5.980-00 гигиенические нормативы (табл. 4).
Качество литьевой воды централизованных систем водоснабжения должно соответствовать требованиям СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
Питьевая вода должна быть безопасна в эпидемическом и радиационном отношении, безвредна по химическому составу и иметь благоприятные органолептические свойства.
Качество питьевой воды должно соответствовать гигиеническим нормативам перед ее поступлением в распределительную сеть, а также в точках водоразбора наружной и внутренней водопроводной сети.
При исследовании микробиологических показателей качества питьевой воды в каждой пробе проводят определение термотолерантных колиформных бактерий, общих колиформных бактерий, общего микробного числа и колифагов (табл. 5).
Таблица 5
Микробиологические показатели качества питьевой воды
(по СанПиН 2.1.4.1074-01)
Примечания:
<1> Превышение норматива не допускается в 95% проб, отбираемых в точках водоразбора наружной и внутренней водопроводной сети в течение 12 месяцев, при количестве исследуемых проб не менее 100 за год.
<2> Определение проводится только в системах водоснабжения из поверхностных источников перед подачей воды в распределительную сеть.
<3> Определение проводится при опенке эффективности технологии обработки воды.
При обнаружении в пробе питьевой воды ТКБ и (или) ОКБ, и (или) колифагов проводят их определение в повторно взятых в экстренном порядке пробах. В таких случаях для выявления причин загрязнения одновременно определяют содержание хлоридов, азота аммонийного, нитратов и нитритов.
При обнаружении в повторно взятых пробах воды ОКБ в количестве более 2 кл в 100 мл и (или) ТКБ, и (или) колифагов проводят исследование проб воды для определения патогенных бактерий кишечной группы и (или) энтеровирусов.
Исследования питьевой воды на наличие патогенных бактерий кишечной группы и энтеровирусов проводят также по эпидемическим показаниям.
Требования к качеству воды нецентрализованного водоснабжения, выбору места расположения, оборудованию и содержанию водозаборных сооружений и прилегающей к ним территории устанавливает СанПиН 2.1.4.544-96 «Требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников». Этот документ устанавливает требования для подземных источников нецентрализованного водоснабжения, захват вод из которых осуществляется путем устройства и специального оборудования водозаборных сооружений (колодцы, каптажи родников) общественного и индивидуального пользования.
Из микробиологических показателей контролируется количество БГКП: коли-индекс не должен превышать 10.
В профилактике бактериального загрязнения питьевой воды решающее значение в первую очередь имеет правильное содержание и эксплуатация водозаборных сооружений. В радиусе ближе 20 м от колодца не допускается мытье автомашин, водопой животных, стирка и полоскание белья, а также осуществление других видов деятельности, способствующих загрязнению воды.
Если при текущем контроле за качеством воды в колодце отмечено увеличение коли-индекса по сравнению с нормативом, следует провести дополнительные исследования воды на наличие фекальных колиформных бактерий, а также аммонийных соединений, нитратов и хлоридов. Появление указанных химических веществ в воде в концентрациях, превышающих нормативные величины, или увеличение содержания их по сравнению с результатами предыдущих исследований свидетельствуют о наличии органического загрязнения воды, причина которого должна быть установлена и ликвидирована, и проведена профилактическая дезинфекция колодца.
Особое значение имеет контроль воды плавательных бассейнов, поскольку через воду передаются возбудители многих грибковых, вирусных, бактериальных и паразитарных заболеваний. Санитарные требования к проектированию, строительству и режиму эксплуатации плавательных бассейнов, качеству поступающей и содержащейся в них воды и ее обеззараживанию, а также к уборке и дезинфекции помещений установлены в СанПиН 2.1.2.568-96 «Гигиенические требования устройству, эксплуатации и качеству воды плавательных бассейнов».
Так, в соответствии с этим документом, качество пресной воды, поступающей в ванну бассейна, должно отвечать гигиеническим требованиям к качеству воды централизованных систем питьевого водоснабжения (табл. 5).
В процессе эксплуатации бассейна вода, находящаяся в ванне, должна соответствовать требованиям, указанным в таблице 6.
Таблица 6
Микробиологические показатели и нормативы качества воды в ванне бассейна
(по СанПиН 2.1.2.568-96)
При получении неудовлетворительных результатов по основным микробиологическим показателям в трех последовательно отобранных пробах воды необходимо проведение исследований по дополнительным микробиологическим и паразитологическим показателям на наличие возбудителей кишечных бактериальных и вирусных инфекций, а также кожных и грибковых заболеваний. Выбор возбудителя в каждом конкретном случае должен определяться эпидемической ситуацией.
При получении неудовлетворительных результатов по дополнительным микробиологическим и паразитологическим показателям бассейн подлежит закрытию. Необходима полная смена воды в ванне бассейна с механической ее чисткой и дезинфекцией и последующим отбором проб воды на анализ.
[1] Лецитиназа — фермент, разрушающий клеточные мембраны.
Тема 5. Санитарная микробиология почвы
5.1. Краткая характеристика почвенных микроорганизмов. Биологическое загрязнение почв
Почва является главным резервуаром и естественной средой обитания микроорганизмов, которые принимают активное участие в процессах формирования и самоочищения почвы, а также являются необходимым звеном в круговороте всех биогенных элементов (углерода, азота, серы, фосфора железа и др.).
Качественный состав микробиоты почв очень разнообразен: спорообразующие и неспорообразующие бактерии, актиномицеты, архебактерии, микоплазмы, цианобактерии (сине-зеленые водоросли), микромицеты и др. Количество микроорганизмов в разных почвах также отличается большой динамичностью. Состав и соотношение между различными группами микроорганизмов изменяется в зависимости от вида почв, способов ее обработки, содержания органических веществ, влаги, температуры, глубины залегания слоя, присутствия различного рода загрязнителей. В качестве примера в таблице 7 приведены данные по количественному содержанию различных групп почвенных микроорганизмов в зависимости от степени окультуренности почв.
Таблица 7
Численность отдельных групп микроорганизмов в разных почвах
(по Мишустину и др., 1979)
| Почва | Состояние | Общая численность, 108 кл/г | Численность сапротрофов, 106 кл/г | Титр нитрификаторов |
| подзолистые и дерново- подзолистые | целинные | 0,6-1,0 | 1,1 | выше 0,01 |
| окультуренные | 10-20 | 2,6 | 0,01 | |
| огородные | — | 5,3 | 0,001 | |
| черноземы | целинные | 20-25 | 3,6 | 0,01 |
| окультуренные | 25-30 | 4,5 | 0,001 |
Все почвенные бактерии являются компонентами различных биотических сообществ, складывающихся в почве в процессе их взаимоотношений с растениями, беспозвоночными животными, простейшими, грибами. Они способны осуществлять уникальные функции и участвовать в деструкции растительных остатков в ассоциациях с другими представителями почвенной биоты. Микробная система почв включает следующие функциональные группы[1] микроорганизмов:
— участвующие в превращениях соединений азота (аммонификаторы. нитрификаторы. денитрификаторы, азотфиксаторы);
— осуществляющие различные этапы трансформации соединений углерода (аэробные и анаэробные гидролитики, расщепляющие полимеры; бактерии, вызывающие различные виды брожений и др.);
— принимающие участие в циклах серы, фосфора, железа и др.
Взаимосвязь между ними осуществляется на основе последовательного потребления пищевых ресурсов и протекания процессов разложения органических веществ. В результате микроорганизмы оказываются способными утилизировать множество различных соединений – природных и созданных человеком.
Для каждой почвы характерен определенный тип микробного сообщества, который отражает его адаптацию к тем условиям, которые складываются в этой почве. Установившиеся взаимоотношения между различными группами почвенных микроорганизмов – от симбиотических до антагонистических – приводят к относительной стабильности микробных ценозов почв и тенденции к устранению чуждых для них форм. Таким образом, активно функционирующая микробная система позволяет почвам «самоочищаться» от попадающих в них разнообразных химических веществ, а также от различных видов биологического загрязнения.
Биологическое загрязнение почв – составная часть органического загрязнения, обусловленного присутствием возбудителей инфекционных и инвазионных болезней, а также вредными насекомыми и клещами, переносчиками возбудителей болезней человека, животных и растений. Источниками биологического загрязнения являются человек и животные, а также хозяйственно-бытовые и промышленные отходы.
Особо опасную роль в эпидемическом отношении играют неизбежно попадающие в почву фекальные массы, содержащие как представителей нормальной микробиоты человека и животных, так и патогенных микроорганизмов. Для того чтобы оценить роль почвы в передаче инфекционных заболеваний, необходимо знать возможную продолжительность сохранения и размножения патогенных бактерий в почве. Так,
— возбудитель ботулизма Clostridium botulinum, образуя споры, сохраняется в почве неопределенно долго, практически постоянно обитает в ней;
— споры возбудителя сибирской язвы Bacillus anthracis, попадающего в почву с трупами погибших животных, обнаруживаются в ней через десятки лет («проклятые поля»), кроме того микроб может вегетировать в почве при температуре не ниже 12°С, достаточной влажности, наличии гумуса и микроэлементов. Длительно способны сохраняться и даже размножаться при благоприятных условиях возбудители столбняка Clostridium tetani и газовой гангрены Clostridium perfringens;
— неспорообразующие патогенные микроорганизмы (сальмонеллы, шигеллы, лептоспиры, франсиселлы и др.) могут находиться в почве в течение нескольких недель или месяцев.
На продолжительность выживания патогенных микроорганизмов в почве оказывают влияние различные физико-химические факторы (температура, влажность, действие солнечного света, количество питательных веществ, и т.д.), а также биологические факторы (взаимоотношения между различными группами микроорганизмов, антагонизм сапротрофов, простейших, действие фагов, и др.).
Почвы характеризуются не только составом и численностью разных групп микроорганизмов, но и суммарной их активностью, а также активностью биохимических процессов, обусловленных наличием в почве определенного запаса (пула) ферментов, выделенных в результате деятельности растений и микроорганизмов. Все эти показатели включаются в понятие биологической активности почв.
Биологическая активность характеризует масштабы, направление и интенсивность переработки различных веществ, попадающих в почву. Наряду с составом и соотношением между различными группами микроорганизмов этот показатель также используется для контроля за изменениями в почвах, которые возникают чаще всего при антропогенном воздействии.
[1] Под функциональными группами понимают группы микроорганизмов, выполняющих при определенных условиях одну и ту же физиологическую функцию в цепи превращения веществ (физиологическая группа).
5.2. Санитарно-микробиологическое исследование почвы
Санитарно-микробиологическая оценка почвы является важным звеном при осуществлении предупредительного и текущего санитарного надзора за качеством почв.
Предупредительный надзор осуществляется:
- при планировке, строительстве и реконструкции вновь заселяемых участков и населенных мест;
- при выборе участков для строительства детских дошкольных учреждений, санаториев, мест отдыха и т.п.;
- при строительстве водохранилищ;
- при решении вопросов водоснабжения и канализации;
- при санитарной оценке почв на полях орошения и т.д.
Текущий санитарный надзор осуществляется:
- при оценке степени биологической контаминации почвы и ее способности к самоочищению;
- при контроле за почвенными и биотермическими методами обезвреживания сточных вод;
- по эпидемическим показаниям для выяснения возможных путей передачи возбудителей инфекционных заболеваний через почву.
Требования к качеству почв населенных мест и сельскохозяйственных угодий при размещении, проектировании, строительстве, реконструкции (техническом перевооружении) и эксплуатации объектов различного назначения устанавливают санитарные правила СанПиН 2.1.7.1287-03 «Санитарно-эпидемиологические требования к качеству почвы».
Санитарно-эпидемиологические требования предъявляются к жилым территориям, рекреационным и курортным зонам, зонам санитарной охраны водоемов, санитарно-защитным зонам, территориям сельскохозяйственного назначения, зонам влияния автотранспорта, захороненных промышленных отходов (почва территорий, прилегающих к полигонам), в местах временного складирования промышленных и бытовых отходов и других, где возможно влияние загрязненных почв на здоровье человека и условия проживания.
Гигиеническая оценка почвы проводится с целью определения ее качества и степени безопасности для человека, а также разработки мероприятий (рекомендаций) по снижению химических и биологических загрязнений (мероприятий по рекультивации, профилактике инфекционной и неинфекционной заболеваемости и др.). В настоящее время она приобретает все большее значение в связи с экологической и эколого-бонитировочной оценкой почв и земель при проведении их комплексной оценки.
Опасность загрязнения почв определяется уровнем ее возможного отрицательного влияния на контактирующие среды: вода, воздух, пищевые продукты, а также прямого или опосредованного воздействия на человека, биологическую активность почвы и процессы самоочищения.
Санитарное состояние почв[1] населенных мест оценивается
комплексно по санитарно-хмическим, санитарно-бактериологическим, санитарно-паразитологическим, санитарно-энтомологическим показателям. Последние три группы показателей отражают степень биологического загрязнения почв.
В первую очередь обследуют почвы территорий повышенного риска воздействия на здоровье населения — детских и образовательных учреждений, спортивных, игровых, детских площадок жилой застройки, площадок отдыха, зон рекреации, зон санитарной охраны водоемов, прибрежных зон, санитарно-защитных зон.
Отбор, транспортирование, хранение, подготовка к анализу и анализ проб осуществляется в соответствии с утвержденными нормативными документами:
• ГОСТ 17.4.4.02-84 «Методы отбора и подготовки проб почвы для химического, бактериологического и гельминтологического анализа»;
• МУ 2.1.7.730-99 «Почва, очистка населенных мест, бытовые и промышленные отходы, санитарная охрана почвы. Гигиеническая оценка качества почвы населенных мест»;
• МУ по санитарно-микробиологическому исследованию почвы № 2293-81. Утв. МЗ СССР 19.02.81.
Программа обследования почвы определяется в каждом конкретном случае с учетом:
— целей и задач исследования;
— характера землепользования;
— специфики источников загрязнения, определяющих характер (состав и уровень) загрязнения изучаемой территории (табл.8).
[1] Санитарное состояние почвы – совокупность физико-химических и биологических свойств почвы определяющих качество и степень ее безопасности в эпидемическом и гигиеническом отношениях
Таблица 8
Некоторые показатели оценки санитарного состояния почв населенных мест в зависимости от их функционального назначения (по СанПиН 2.1.7.1287-03)
| № п/п | Наименование показателя | Объекты наблюдения (функциональные зоны, территории) | ||||||
| Жилая зона | Детские дошкольные и школьные учреждения, игровые площадки, территории дворов | Зоны санитарной охраны водоемов | Рекреационные зоны (скверы, парки, бульвары, пляжи, лесопарки) | Транспортные магистрали | Промышленная зона | Почвы с/х (опытные поля, сады и огороды, приусадебные участки, тепличные хоз-ва) | ||
| 1 | Санитарное число (отношение белкового азота к общему органич. азоту) | /- | /- | /- | — | — | — | — |
| 2 | рН | /- | /- | /- | /- | /- | /- | /- |
| 3 | Лактозоположительные кишечные палочки (Колиформы), индекс*: | |||||||
| 4 | Энтерококки (фекальные стрептококки), индекс | |||||||
| 5 | Патогенные микроорганизмы (по эпидпоказаниям), индекс | |||||||
Примечания:
*- допускается определение фекальных форм;
« » — показатель, обязательный при оценке санитарного состояния почв;
«-» — показатель необязательный;
« /-» — показатель обязательный при наличии источника загрязнения.
Степень биологического загрязнения почвы оценивается, как уже было сказано, по санитарно-бактериологическим, санитарно-паразитологическим и санитарно-энтомологическим показателям. Рассмотрим более подробно санитарно-бактериологические показатели.
В загрязненной почве на фоне уменьшения истинных представителей почвенных микробоценозов (антагонистов патогенной кишечной микрофлоры) и снижения ее биологической активности отмечается увеличение положительных находок патогенных энтеробактерий и геогельминтов, которые более устойчивы к химическому загрязнению почвы, чем представители естественных почвенных микробоценозов. Это является одной из причин необходимости контроля эпидемиологической безопасности почвы населенных пунктов, так как с увеличением химической нагрузки эпидемиологическая опасность почвы может возрастать.
На объектах повышенного риска оценка санитарного состояния почвы проводится на основании результатов анализов почв по следующим санитарно-бактериологическим показателям.
1. Косвенные, характеризующие интенсивность биологической нагрузки на почву.
Это санитарно-показательные организмы группы кишечной палочки: БГКП (Коли-индекс) и фекальные стрептококки (индекс энтерококков). В крупных городах с высокой плотностью населения биологическая нагрузка на почву очень велика, и как следствие, высоки индексы санитарно-показательных организмов.
2. Прямые санитарно-бактериологические показатели эпидемической опасности почвы.
Это обнаружение возбудителей кишечных инфекций, патогенных энтеробактерий, энтеровирусов.
Результаты анализов оцениваются в соответствии с таблицей 9.
При отсутствии возможности прямого определения в почвах энтеробактерий и энтеровирусов оценка безопасности может быть проведена ориентировочно по индикаторным микроорганизмам:
— почву оценивают как «чистую» без ограничений по санитарно-бактериологическим показателям при отсутствии патогенных бактерий и индексе санитарно-показательных микроорганизмов до 10 кл/г почвы;
— о возможности загрязнения почвы сальмонеллами свидетельствует индекс санитарно-показательных организмов (БГКП и энтерококков) 10 и более кл/г почвы;
— концентрация колифага в почве на уровне 10 БОЕ/г и более свидетельствует об инфицировании почвы энтеровирусами.
Таблица 9
Оценка степени биологического загрязнения почвы (по СанПиН 2.1.7.1287-03)
Примечание: «-» — отсутствие в почве; » » — наличие в почве.
При необходимости углубленной оценки санитарного состояния почвы и ее способности к самоочищению проводят исследования по биологической активности почвы.
Основными интегральными показателями биологической активности почвы являются:
— общая микробная численность (ОМЧ);
— численность основных групп почвенных микроорганизмов (почвенных сапротрофных бактерий, актиномицетов, почвенных микромицетов);
— показатели интенсивности трансформации соединений углерода и азота в почве («дыхание» почвы, «санитарное число», динамика азота аммиака и нитратов в почве, азотфиксация, аммонификация, нитрификация и денитрификация);
— динамика кислотности и окислительно-восстановительного потенциала;
— активность ферментативных систем и другие показатели.
Перечень показателей определяется целями исследования, природой и интенсивностью загрязнения, характером землепользования. На первом этапе исследований целесообразно использование наиболее простых и быстро определяемых информативных интегральных показателей: «дыхание» почвы. ОМЧ, окислительно-восстановительный потенциал и кислотность почв, динамика азота аммиака и нитратов.
Дальнейшее углубленное исследование проводится в соответствии с полученными результатами и общими задачами исследования. Так, почву можно считать «незагрязненной» по показателям биологической активности при изменениях в микробиологических показателях не более 50% и биохимических – не более 25% по сравнению с такими же для контрольных, принятых в качестве чистых незагрязненных почв.
Общее заключение о санитарном состоянии почв обследуемой территории, как уже было сказано, дается на основании результатов проведенных комплексных исследований, в которых санитарно-бактериологический анализ является важнейшим звеном.
Тема 6. Санитарно-микробиологическое исследование воздуха и предметов окружающей среды
6.1. Воздух как среда обитания микроорганизмов. Биологическая контаминация воздушной среды
С экологической точки зрения воздух представляет собой среду, неблагоприятную для жизни микроорганизмов. Здесь на них оказывают воздействие такие губительные факторы, как солнечная радиация, колебания температуры, высыхание, действие фитонцидов, атмосферные осадки, а также отсутствие питательных веществ. Тем не менее в воздухе, наряду с водой и почвой, постоянно обнаруживается значительное количество микроорганизмов, способных довольно долго сохраняться в нем.
Микроорганизмы в воздухе находятся в виде аэрозолей. Бактериальный аэрозоль — это коллоидная система, состоящая из воздуха, мельчайших капелек воды или частиц твердых веществ, в которые включены микроорганизмы. Водная и водно-солевая оболочка предохраняет их от высыхания. В зависимости от размера капелек, скорости их движения в воздухе различают следующие фазы бактериальных аэрозолей:
- капельная или крупнокапельная. Диаметр частиц аэрозоля более 0,1 мм. Микробная клетка окружена водно-солевой оболочкой, капли быстро оседают, длительность пребывания в воздухе — несколько секунд;
- капельно-ядерная или мелкокапельная. Диаметр частиц аэрозоля менее 0,1 мм. Эта фаза образуется из капельной фазы, когда капли теряют свою водно-солевую оболочку и переходят в фазу высохших бактериальных капель — ядрышек. В капельных ядрышках частично сохраняется влага, что обеспечивает жизнеспособность микроорганизмов в них.
- фаза бактериальной пыли. Образуется из первых двух фаз при их высыхании и осаждении на частицах пыли. Частицы могут иметь разный размер: от 0,001 мм до 1 мм. В зависимости от размера, они могут находиться во взвешенном состоянии или оседать, поднимаясь в воздушную среду при определенных условиях.
Наибольшее эпидемиологическое значение имеют фазы с размером частиц до 0,1 мм, поскольку они длительно находятся в воздухе, переносятся на значительные расстояния, способны проникать глубоко в альвеолы легких, преодолевая защитные барьеры верхних дыхательных путей
Чисто условно микроорганизмы воздуха можно разделить на две группы:
— постоянные («истинные воздушные», по Н.Г. Холодному), которые наиболее часто обнаруживаются в воздушной среде;
— переменные, находящиеся в воздухе не всегда и менее стойкие к воздействию различных факторов окружающей среды.
Постоянная микробиота формируется за счет микроорганизмов почвы. К ней относятся различные пигментообразующие кокки, неспорообразующие и спорообразующие палочки, актиномицеты, грибы и др. Это, например, Micrococcus roseus, М. flavus, Sarcina rosea, S. flava, Bacillus mycoides, Penicillium и др. Благодаря содержанию каротиноидов эти микроорганизмы более устойчивы к воздействию солнечных лучей, что обеспечивает их способность сохраняться в воздухе.
Переменная составляющая микробного населения воздушной среды формируется при контаминации воздуха за счет:
— сапротрофных микроорганизмов почвы и воды, попадающих в воздух в ветреную погоду с пылью, капельками воды (p.p. Micrococcus, Bacillus и др.);
— нормальной микробиоты человека и животных (p. Staphylococcus);
— патогенных микроорганизмов от больных людей и животных или бактерионосителей (например, Mycobacterium tuberculosis).
Представители нормальной микробиоты и патогенные микроорганизмы попадают в воздушную среду при разговоре, кашле, чихании, со слущивающимся эпидермисом кожных покровов, из открытых гнойных очагов на любых частях тела, с постельного белья и т.п.
Качественный и количественный состав микроорганизмов воздуха очень динамичен и зависит от многих факторов: характера почвенного покрова; удаленности от поверхности почвы, от населенных пунктов, промышленных и сельскохозяйственных предприятий; от общесанитарного состояния местности или населенного пункта, наличия зеленых насаждений; от сезонных, климатических, метеорологических факторов.
Существенно отличается бактериальная обсемененность атмосферного воздуха и воздуха закрытых помещений. В закрытых помещениях воздух, как правило, всегда более загрязнен, чем атмосферный. Величина бактериального загрязнения воздуха закрытых помещений складывается из:
— бактериальных аэрозолей атмосферного воздуха;
— бактериальных аэрозолей, формирующихся в помещении.
Значение второй составляющей определяется санитарным состоянием помещения, характером его использования, состоянием вентиляции, численностью и поведением людей, клиническим состоянием респираторных органов и др.
6.2. Санитарно-микробиологическое исследование воздуха
Задачами санитарно-микробиологического исследования воздуха являются:
— гигиеническая и эпидемиологическая оценка воздушной среды:
— разработка комплекса мероприятий, направленных на профилактику аэрогенной передачи возбудителей инфекционных болезней.
При оценке санитарного состояния закрытых помещений в зависимости от задач исследования определяют:
- общее микробное число;
- присутствие санитарно-показательных микроорганизмов (стафилококков, α- и ß-гемолитических стрептококков);
- при обследовании хирургических, родильных отделений — условно-патогенных микроорганизмов р. Proteus, Klebsiella, Pseudomonas aeruginosa (синегнойная палочка) и др., которые могут вызывать внутрибольничные инфекции или осложнения после операций;
- непосредственно патогенных микроорганизмов – по эпидемическим показаниям при расшифровке вспышек заболеваний, передающихся аэрогенным путем.
Исследование воздуха закрытых помещений проводится в медицинских, детских, культурных учреждениях, на различных предприятиях. Следует отметить, что разработка нормативов по бактериальной обсемененности воздушной среды представляет большие трудности, прежде всего из-за того, что воздух — среда очень динамичная и его санитарно-микробиологическое состояние зависит от многих факторов.
Для лечебных учреждений в зависимости от их функционального назначения уровень бактериальной обсемененности воздушной среды регламентируется в соответствии с СанПиН 2.1.3.1375-03 «Гигиенические требования к размещению, устройству, оборудованию и эксплуатации больниц, родильных домов и других лечебных стационаров» (табл. 10).
Таблица 10
Допустимые уровни бактериальной обсемененности воздушной среды помещений лечебных учреждений
| Класс чистоты | Название помещения | Санитарно-микробиологические показатели | |||||
| Общее микробное количество (КОЕ/м3) | Кол-во колоний S. аureus (КОЕ/м3) | Кол-во плесневых и дрожжевых грибов в 1 дм3 воздуха | |||||
| До начала работы | Во время работы | До начала работы | Во время работы | До начала работы | Во время работы | ||
| Особо чистые (А) | Операционные, родильные залы, боксы для гематологических, ожоговых пациентов, палаты для недоношенных детей, боксы баклабораторий | Не более 200 | Не должно быть | Не должно быть | |||
Чистые (Б) | процедурные, перевязочные, палаты реанимации, детские палаты | не более 500 | не должно быть | не должно быть | |||
Условно-чистые (В) | палаты хирургических отделений, коридоры, примыкающие к операционным залам, ординаторские, смотровые боксы, кладовые чистого белья | не более 750 | не более 1000 | не должно быть | не более 2 | не должно быть | не должно быть |
| Грязные (Г) | коридоры и помещения административных зданий, лестничные марши, комнаты для грязного белья, санитарные комнаты, туалеты | не нормируется | не нормируется | не нормируется | |||
Важным объектом контроля за бактериальной обсемененностью воздуха являются парикмахерские (СанПиН 2.1.2.1199-03 «Парикмахерские. Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию»). Санитарные правила разработаны с целью предотвращения возникновения и распространения инфекционных и неинфекционных заболеваний среди клиентов и персонала парикмахерских независимо от их категории по уровню обслуживания клиентов.
Пробы воздуха на бактериальную обсемененность отбирают в кабинетах: педикюра, маникюра, косметическом и косметологическом. Отбор проб воздуха производят при соблюдении следующих условий:
— чистое, подготовленное к работе помещение;
— закрытые форточки и двери;
— уровень отбора проб соответствует рабочей зоне (1,5 м от пола);
— не ранее чем через 30 минут после влажной уборки помещения.
При оценке санитарного состояния руководствуются следующими нормами: в 1 м3 воздуха общее количество колоний микроорганизмов (ОМЧ) не должно превышать 1 500, количество золотистого стафилококка — до 100, количество плесневых и дрожжевых грибов – до 20.
Для обеззараживания воздуха в учреждениях различного профиля (лечебных, парикмахерских, организациях пищевой промышленности и др.) должно применяться ультрафиолетовое бактерицидное излучение. Основные требования к нему, а также методика определения микробной обсемененности изложены в следующих документах:
Эффективность УФ-облучения помещений (бактерицидная эффективность) оценивается по степени микробной обсемененности воздуха, поверхностей, ограждений и оборудования до и после облучения и выражается в процентах. Значение показателя бактерицидной эффективности устанавливается в зависимости от категории помещения.
Для примера в таблице 11 представлен необходимый уровень бактерицидной эффективности (по санитарно-показательному микроорганизму S. aureus) для различных помещений предприятий пищевой промышленности.
Таблица 11
Необходимый уровень бактерицидной эффективности для санитарно-показательного микроорганизма S. aureus в помещениях, подлежащих оборудованию УФ-облучателями для обеззараживания воздуха (МУ 2.3.975-00)
На предприятиях микробиологической промышленности, где в производстве используются в качестве продуцентов различные микроорганизмы, исследуют количественное и качественное содержание в воздухе микробов-продуцентов с целью предупреждения воздействия их на организм работающих людей (возможность заболевания и развитие сенсибилизации[1]). Нормирование качества воздушной среды в этом случае осуществляется в соответствии с ГН 2.1.6.1041-01 «Предельно-допустимые концентрации (ПДК) микроорганизмов-продуцентов, бактериальных препаратов и их компонентов в атмосферном воздухе населенных мест». ПДК некоторых микроорганизмов-продуцентов в воздухе рабочей зоны приведены в таблице 12.
[1] Сенсибилизация (лат. sensibilis – чувствительный) — повышение реактивной чувствительности организмов, их клеток и тканей.
Таблица 12
ПДК микроорганизмов-продуцентов в воздухе рабочей зоны
Для закрытых жилых и иных помещений, не рассмотренных выше, узаконенных нормативов по бактериальной обсемененности воздуха не существует.
Для оценки чистоты воздуха закрытых помещений рекомендуют ориентироваться на местные «нормативы», которые устанавливаются для каждого помещения после его тщательной уборки как среднее арифметическое нескольких исследований. Полученные результаты принимаются за «норматив» для данного помещения.
Во всех случаях, когда в воздухе жилых или производственных помещений обнаруживаются патогенные микроорганизмы, воздух считается загрязненным и эпидемически опасным.
Для характеристики санитарного состояния атмосферного воздуха рекомендуется определять общее микробное число, а также качественный состав микроорганизмов с учетом спорообразующих аэробов, анаэробов и гемолитических бактерий.
Санитарно-микробиологическому исследованию в последнее время все чаще подвергается воздух крупных животноводческих комплексов и птицефабрик, так как в нем могут присутствовать в больших количествах стафилококки, стрептококки, клостридии, бактерии кишечной группы, микроскопические грибы и др.
В местах орошения земледельческих полей сточными водами методом дождевания проводят исследования с целью обнаружения сальмонелл, патогенных эшерихий. Такие исследования проводят по эпидемическим показаниям при появлении случаев заболевания среди персонала или населения.
6.3. Биологическая контаминация предметов окружающей среды. Их гигиеническая и эпидемиологическая оценка
Биологическая контаминация предметов окружающей человека среды происходит постоянно. Источниками их микробного загрязнения являются человек, животные, насекомые. Загрязнение происходит также из воздуха с пылью и аэрозолями, из почвы и воды. При этом на окружающих предметах могут обнаруживаться как сапротрофные, так и условно-патогенные и патогенные микроорганизмы.
Попавшие на предметы окружающей среды микроорганизмы, в том числе и патогенные, как правило, не размножаются на них. Такие объекты служат пассивными посредниками при передаче возбудителей инфекционных болезней и условно-патогенных микроорганизмов. Возможность заражения человека при этом зависит от количества микроорганизмов, их вирулентности, сроков выживания на предметах обихода, оборудовании и большая часть микробов погибает в первые часы пребывания на объектах внешней среды, за исключением тех, которые остаются в складках, трещинах, впадинах, где они в меньшей мере подвергаются высыханию и инсоляции. Длительно могут сохраняться и спорообразующие бактерии. Например, споры бацилл сибирской язвы (Bacillus anthracis) годами могут находиться в изделиях из меха, шерсти, кожи животных, погибших от этого заболевания, и представляют реальную опасность заражения.
Продолжительность сохранения жизнеспособности некоторых патогенных микроорганизмов на различных объектах отражена в таблице 13.
Таблица 13
Длительность сохранения жизнеспособности патогенных микроорганизмов на объектах окружающей среды (по З.Н. Кочемасовой и др., 1987)
Предметы обихода, а также различное оборудование подвергаются санитарно-микробиологическому обследованию по двум причинам:
- их микробная обсемененность наиболее четко отражает гигиеническое состояние среды, непосредственно окружающей человека;
- такие предметы могут служить посредниками при передаче возбудителей многих инфекционных заболеваний.
Санитарно-микробиологическое исследование предметов окружающей среды проводят:
— при текущем микробиологическом контроле санитарно-гигиенического режима в детских, лечебных учреждениях, на пищевых предприятиях;
— по эпидемическим показаниям в очагах при острых инфекционных заболеваниях;
— для выяснения причин разрушения и порчи некоторых объектов.
В зависимости от целей исследования проводят определение тех или иных микробиологических показателей.
Так, при контроле санитарно-гигиенического режима определяют:
— общую микробную обсемененность;
— наличие санитарно-показательных микроорганизмов — индикаторов фекального и воздушно-капельного (воздушно-пылевого) загрязнения, а также условно-патогенных (протей, синегнойная палочка). Это особенно важно в учреждениях хирургического и родовспомогательного профиля для предотвращения осложнений после операций и профилактики внутрибольничных инфекций;
по эпидемическим показаниям:
— наличие патогенных микроорганизмов для выяснения возможных путей передачи инфекции;
при выяснении причин разрушения и порчи объектов:
— вид возбудителя порчи и разрушения для правильной организации борьбы по его уничтожению (например, при разрушении древесины домовым грибом).
При оценке результатов санитарно-микробиологического исследования предметов окружающей среды исходят из цели обследования.
Контроль предприятий общественного питания и торговли пищевыми продуктами. Имеющиеся инструктивные материалы по cанитарно-микробиологическому контролю предприятий общественного питания и торговли пищевыми продуктами указывают на то, что фекальное загрязнение должно быть исключено на оборудовании, не соприкасающимся с сырыми продуктами, а также на вымытой посуде.
На всех обследуемых предметах и оборудовании не должны обнаруживаться патогенные микроорганизмы.
Контроль лечебных учреждений. В лечебных учреждениях фекального загрязнения не всегда удается избежать, поэтому для них допускается содержание БГКП в 5% проб, при этом санитарное состояние обследуемого лечебного учреждения расценивается как удовлетворительное.
В то же время выделение патогенных стафилококков (особенно полирезистентных к антибиотикам) с предметов обихода и от персонала в хирургических и родильных отделениях свидетельствует о санитарном неблагополучии и является предвестником развития внутрибольничных инфекций. В этом случае обязательно проводят профилактические мероприятия по улучшению санитарного состояния и установлению источников патогенных микроорганизмов (дезинфекционные мероприятия, обследование персонала).
Для обеззараживания поверхностей помещений в лечебных учреждениях должно применяться УФ-излучение, а также осуществляться влажная уборка помещений (обработка полов, мебели, оборудования, подоконников, дверей, инвентаря) с использованием моющих и дезинфицирующих средств.
Обследование объектов на стерильность. При обследовании различных объектов на стерильность (перевязочный, шовный материал, системы переливания крови многоразового использования и др.) не должно быть роста во всех посевах. Бактериологический контроль стерильности изделий медицинского назначения осуществляется в соответствии с приказом Минздрава СССР от 03.09.91 № 254 «О развитии дезинфекционного дела в стране», СП 3.5.1378-03 «Санитарно-эпидемиологические требования к организации и осуществлению дезинфекционной деятельности» и рядом других документов.
Контроль парикмахерских. При проведении контроля особое внимание уделяют такому потенциально опасному фактору как качество обработки рабочих инструментов в парикмахерских залах, маникюрных, педикюрных, косметологических и косметических кабинетах, от которого зависит возможность передачи возбудителей инфекционных и паразитарных заболеваний. Санитарно-микробиологический контроль устанавливается за:
— качеством обработки рабочего инструментария (дезинфекция, предстерилизационная очистка, стерилизация);
— бактериальной обсемененностью воздуха, который может служить источником биологической контаминации инструментов.
Основная литература
- Федеральный закон «О санитарно-эпидемиологическом благополучии населения» от 30 марта 1999 г. № 52-ФЗ.
- Бабьева И.П., Зенова Г.М. Биология почв: Учебник. М.: Изд-во МГУ, 1989.336 с.
- Безденежных И.С. Эпидемиология. М.: Медицина, 1968. 336 с.
- Горленко В.М., Дубинина Г.А., Кузнецов С.И. Экология водных микроорганизмов. М.: Наука, 1977. 287 с.
- Джавец Э. и др. Руководство по медицинской микробиологии: Пер. с англ. М.: Мир, 1982. 346 с.
- Добровольская Т.Г. Структура бактериальных сообществ почв. М.: ИКЦ «Академкнига», 2002. 282 с.
- Кочемасова Ефремова С.А., Рыбакова Санитарная микробиология и вирусология. М.: Медицина, 1987. 352 с.
- Кузнецов С.И., Дубинина Г.А. Методы изучения водных микроорганизмов. М.: Наука, 1989. 288 с.
- Макарорв O.A. Почему нужно оценивать почву? (Состояние / качество почвы: оценка, нормирование, управление, сертификация). М.: Изд-во Моск. ун-та, 2003. 259 с.
- Маянский Микробиология для врачей. Новгород: Изд-во Нижегородской гос. мед. академии, 1999. 400 с.
- Митчелл Р. Микробиология загрязненных вод. М.: Медицина, 1977.320 с.
- Мишустин E.H., Перцовская М.И., Горбов В.А. Санитарная микробиология почвы. М.: Наука, 1979. 304 с.
- Мудрецова-Висс К.А. Микробиология. М.: Экономика, 1978. 240 с.
- Определитель бактерий Берджи: В 2 т.: пер. с англ. Под ред. Дж. Хоулта и др. М.: Мир, 1997.
- Основы медицинской бактериологии, вирусологии и иммунологии / Под ред. Г.М. Шуба: Учеб. пособие. М.: Логос, 2003. 264 с.
- Руководство по эпидемиологии инфекционных болезней. М.: Медицина, 1993. Т. 1 и 2.
- Санитарная микробиология / Под ред. Г.П. Калины и Г.Н. Чистовича. М.: Медицина, 1969. 384 с.
- Семерной В.П. Санитарная гидробиология: Учеб. пособие. Ярославль: Изд-во ЯрГУ, 2001. 147 с.
- Тимаков В.Д. Микробиология. М.: Медицина, 1973. 432 с.
Содержание
Введение…3
Общая часть…4
Тема 1. Санитарная микробиология как наука…4
- Предмет и задачи санитарной микробиологии…4
- Краткая история становления санитарной микробиологии как науки. Государственная санитарно-эпидемиологическая служба РФ…5
- Принципы санитарно-микробиологических исследований…8
- Структура современной санитарной микробиологии…11
1.5. Методы исследования объектов окружающей среды, применяемые в санитарной микробиологии…11
Тема 2. Учение о санитарно-показательных микроорганизмах…17
- Общая характеристика санитарно-показательных микроорганизмов, предъявляемые к ним требования…17
- Группы санитарно-показательных микроорганизмов…19
- Краткая характеристика отдельных представителей санитарно-показательных микроорганизмов…21
- Санитарно-показательные микроорганизмы различных объектов окружающей среды…30
Группы санитарно- показательных микроорганизмов…31
Тема 3. Патогенные микроорганизмы в окружающей среде…32
- Патогенность и вирулентность. Группы патогенных микроорганизмов…32
- Инфекция: основные понятия и определения…36
- Краткая характеристика некоторых патогенных микроорганизмов…39
Специальная часть…50
Тема 4. Санитарная микробиология воды…50
- Краткая характеристика микроорганизмов водоемов. Биологическая контаминация и самоочищение вод…50
- Санитарно-микробиологический контроль качества вод…53
Тема 5. Санитарная микробиология почвы…62
5.1. Краткая характеристика почвенных микроорганизмов. Биологическое
загрязнение почв…62
5.2. Санитарно-микробиологическое исследование почвы…65
Тема 6. Санитарно-микробиологическое исследование воздуха и
предметов окружающей среды…71
- Воздух как среда обитания микроорганизмов. Биологическая контаминация воздушной среды…71
- Санитарно-микробиологическое исследование воздуха…73
- Биологическая контаминация предметов окружающей среды. Их гигиеническая и эпидемиологическая оценка…78
Основная литература…82
Установка штатной магнитолы amundsen /bolero octavia a7 | vag-doctor
Наконец-то установил магнитолу, сначала думал да и не такое ставил, поставлю тоже как другие. Посчитал блок, монитор, провода и все тут, а на деле есть еще много чего дополнительного что нужно купить, это вставка в бардачок, что находится в правом бардачке, она немного другая, если магнитола стояла Swing, то в этой вставке просто ниша для документов, она узкая и в нее блок магнитолы не влезет.
Вставку ставим, но если Вы заказывали вставку с артикулом для РФ, то подсветка будет с другой стороны, чем у Вас было до этого, пришлось с помощью паяльника удлинять этот провод, дешево и сердито, цена бардачка отличается почти в два раза, если не хотите колхоза купите вставку для Европы.
И так вот список оборудования:
Закупка запчастей:
— Блок Amundsen Mib 2.5 Спасибо gellham
— USB разъем с проводом, т.к. у Swing короткий провод. Спасибо Mega-Smart из Казани.
— Монитор 8,2 экран 5E0919605M (разница с болеро в кнопке NAV 5E0919605N) пришел за 3 дня с Белоруссии у kostyaa3.
— Провод Quadlock с али сюда входит провод quadlock удлиненный переходник с питанием для монитора, провод с блока на монитор, микрофон с удлинителем. Шел с Китая 10 дней.
— Вставка в бардачок (производства Россия) в два раза дешевле, хочешь съэкономить, нужно было удлинить провод подсветки бардачка. VAG 5EU857083 9B9
— Камера заднего вида с траекториями (оригинал) в новом поколении уже не требует отдельного блока траекторий, спасибо Vovanoto Кстати у него можно приобрести магнитолы и он может закодировать удаленно, так же заливает параметрию любого блока.
— VAS 5054 был приобретен диагностический адаптер, т.к. именно им рекомендуется прописывать магнитолу и вообще новое поколение ковырять, Вася тут может на косячить, были случаи. Можно почитать про это у Владимира в блоге www.shkoda-avto.ru/b/482333761946517537/?from=blog, но до покупки адаптера мне озвучили цену в нашем городишке, на прописку магнитолы этим же адаптером VAS 5054 в 5000 рублей, за от силы 30 минут работы. И было решено купить его и прописать самому, позже узнал что информации нет в свободном доступе.

Адаптер VAS PC
Далее снял Swing заранее изготовленными ключами, берем кредитную карту, которая вам уже надоела и вы хотите бросить такую привычку, режем ее на 4 полоски по 7мм, ну я на глаз нарезал.
Вставляем сверху в тонкие щели по одной по бокам, затем снизу две в районе крутилок.

Нам видны штатные провода, вставляем наш купленный у Китайцев провод мама-папа, удлиняем 2 провода на микрофон и еще там же три провода до блока. Я удлинил эти провода и переместил разъемы синий и зеленый уже к блоку. От quadlock-а нужно подцепить 2 провода can -/ , чтобы у нас кан был в блоке.
Видим такую картину.

В зеленой фишке 2 провода это 5в и масса это дополнительное питание на USB.
Подключаем камеру на синий разъем это 6 и 12 контакты, а питание берем 12 в 30 и 31 контакты. Более понятней я сделал схему.

Установил вставку для блока и сам блок Amundsen MIB 2.5. Установил программу Одис, и на помощь пришел сам Vovanoto, подключился удаленно и потратил свое драгоценное время и с тех пор все работает. Хочу сказать большое спасибо ему за оказанную работу! Навигация требует подключения GPS антенны, но т.к. у нас установлен Глонасс, можно прописать чтобы данные брались с глонасс антенны, так и было все сделано, прием отличный, проблем не было.
На установку всего этого оборудования ушло 2 дня. Проделанной работой рад, конечно что было и что стало, небо и земля. Замена на другую магнитолу была сделана ради камеры заднего вида.
Ну и напоследок, выложу фотки.

Блок с проводкой
USB кабель выглядит примерно так, но этот пришлось переделать, с одной стороны он должен быть Г-образный, с другой где USB разъем — прямой!


Камера в своем месте

Слайд шоу ваших фото с USB диска

Список радиостанций (сам загрузил иконки с USB диска здесь)

Меню

Голосовые команды

Навигация





